Презентація до уроку " Хімічні реакції"










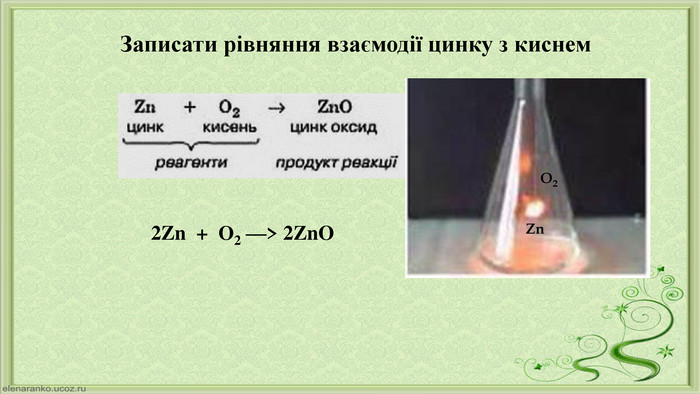









Пригадаємо Усі хімічні реакції зображують хімічними рівняннями. Що називаться хімічним рівнянням?Коефіцієнти – арабські цифри, записані перед хімічною формулою, мають однакові з нею розміри. Коефіцієнти в хімічному рівнянні показують найпростіші співвідношення між кількостями структурних частинок реагентів і продуктів реакції. Хімічне рівняння – це умовний запис хімічної реакції за допомогою хімічних формул і коефіцієнтів. Що називаться коефіцієнтом ?
Скласти рівняння реакціі взаємодії кальцію і кисню. Словесна схема: Кальцій + кисень → кальцій оксид. Вихідні речовини, реагенти. Продукти реакціїХімічна схема: Са + О2 = Са. О Щоб перетворити хімічну схему на хімічне рівняння, потрібно розставити коефіцієнти, тобто, урівняти. Кількість атомів кожного з елементів зліва і справа повинна бути однаковою. Хімічне рівняння: 2 Са + О2 = 2 Са. О Са
Який алгоритм складання хімічного рівняння? 2 Са + О2 = 2 Са. О 1. Скласти схему взаємодії: - ліворуч записуються формули реагентів, праворуч – продукти реакції. - якщо їх декілька – між ними ставиться знак „+”. - між лівою і правою частинами схеми ставиться знак „ →” або „ = ”.2. Розставити коефіцієнти перед хімічними формулам речовин так, щоб в правій і лівій частинах рівняння кількість атомів кожного з елементів була однакова.
Що потрібно знати про коефіцієнт? Розставляючи коефіцієнти, слід пам'ятати такі правила:1. Коефіцієнт ставиться тільки перед хімічною формулою. Не можна ставити коефіцієнт всередину формули : Са + О2 = Са2 ОНе можна змінювати індекси : Са + О2 = Са. О2 Не можна ставити коефіцієнти у кілька разів більші: 4 Са + 2 О2 = 4 Са. О2. Коефіцієнт стосується всіх атомів, із яких складається молекула перед якою він стоїть. 3. Коефіцієнт 1, як і індекс 1, не записується. Коефіцієнти — числа, що стоять перед формулами речовин і показують число частинок даної речовини. 2 Са + О2 = 2 Са. О
Додаткові позначення в рівняннях реакцій. В рівняннях над стрілками часто вказують умови, за яких відбувається реакція: - нагрівання (t), - підвищення тиску (р) - освітлення (hυ)Якщо продуктом реакції є газ, то після його формули записують стрілку, направлену вгору (↑), а якщо утворюється осад, стрілку спрямовують донизу (↓)Zn + 2 HCl → Zn. Cl2 + H2↑Cu. SO4 + 2 Na. OH = Cu(OH)2↓ + Na2 SO4
Аl + O2 —> Al2 O3 Підраховуємо окремо кількість атомів Оксигену у лівій та правій частинах рівняння. В лівій частині хімічного рівняння є 2 атоми Оксигену, у правій — 3. Число атомів різне, тому слід знайти для них найменше спільне кратне (це число 6). Поставимо коефіцієнти так, щоб Оксигену було зліва і справа по 6 атомів. Аl + 3 O2 —> 2 Аl2 O3. Відтепер запис 2 Аl2 O3 позначає після реакції не лише 6 атомів Оксигену, але й 4 атоми Алюмінію. За законом збереження маси речовин до реакції і після реакції кількість атомів однакова. Тож перед Аl у лівій частині рівняння пишемо коефіцієнт 4: 4 Аl + 3 O2 → 2 Al2 O3. Перевіряймо правильність розстановки коефіцієнтів. Прочитаємо написане рівняння: «чотири-алюміній плюс три-о-два дорівнює два-алюміній-два-о-три». Записати рівняння взаємодії алюмінію з киснем. Al. O2


про публікацію авторської розробки
Додати розробку




















-

Рєпнікова Алла Миколаївна
25.01.2024 в 07:15
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Шатовський Валентин Олександрович
12.12.2023 в 07:36
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Шишко Анастасія Іванівна
13.05.2022 в 13:20
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Товстолес Лариса
12.05.2022 в 09:33
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 1 відгук