Презентація до уроку "Кислоти. Хімічні властивості кислот."
Про матеріал
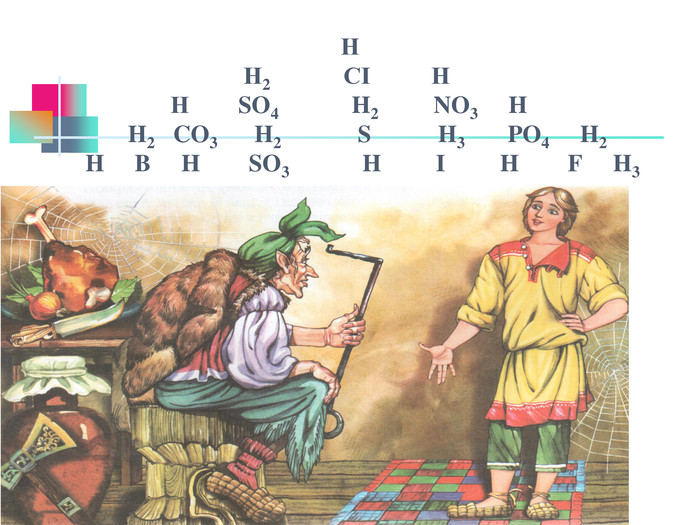
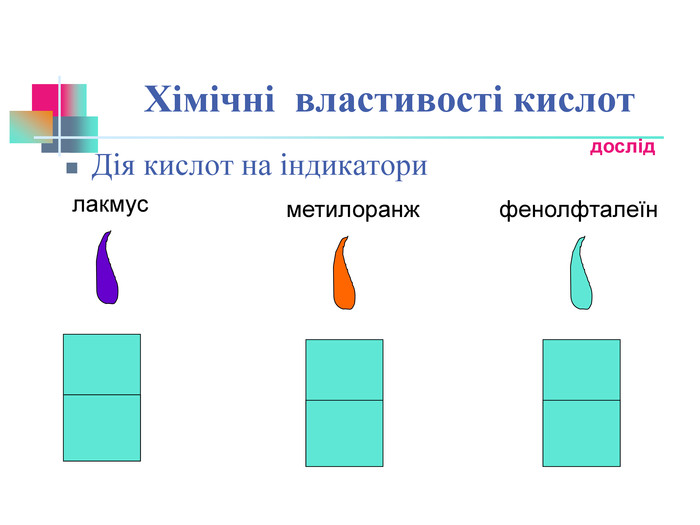
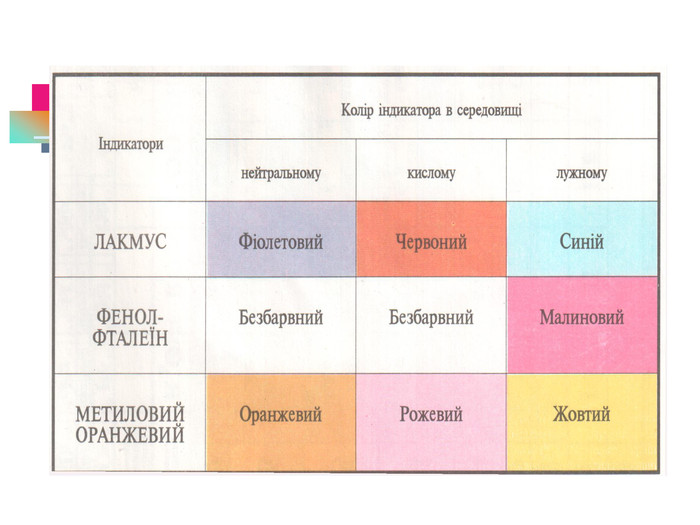
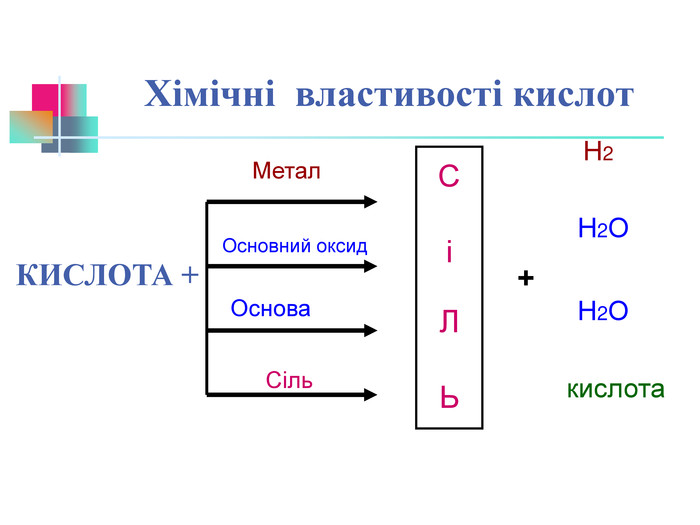
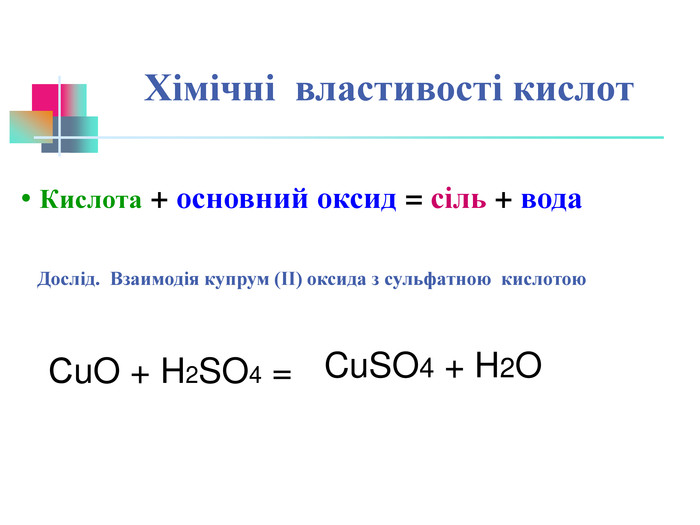
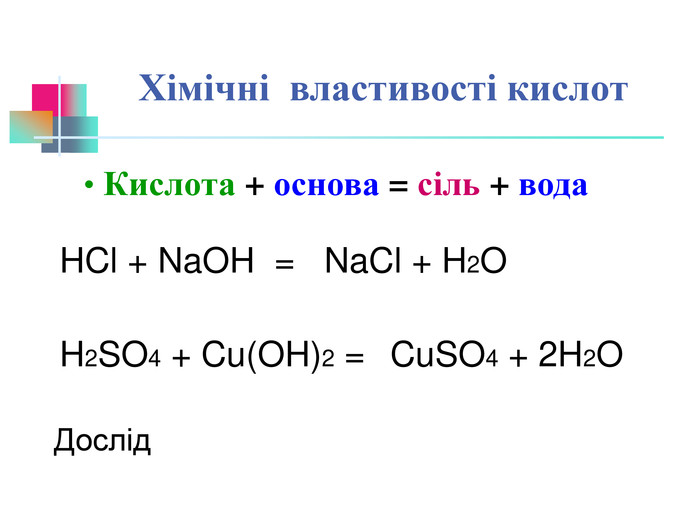
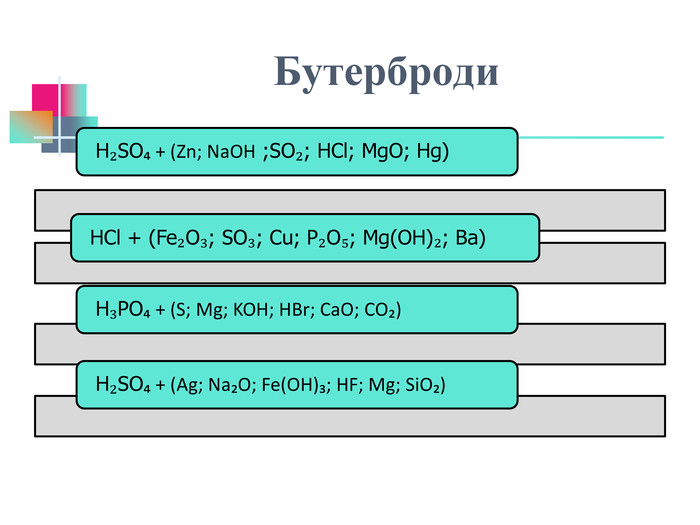
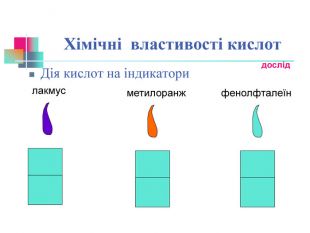
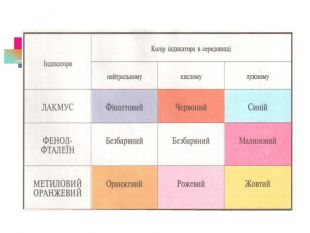
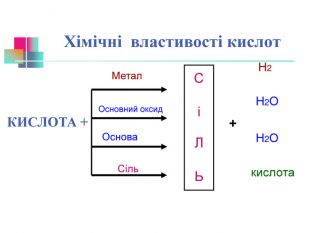
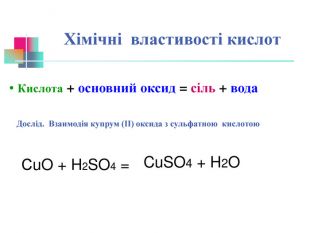
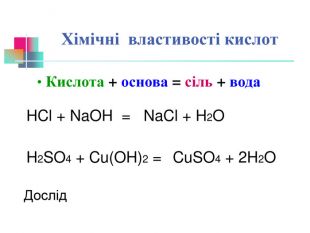
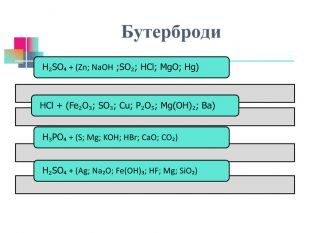
В презентації надається інформація про хімічні властивості кислот, та заходи безпеки під час роботи з кислотами. Презентація розповідає про наявність кислот в оточуючому середовищі. На закріплення - "хімічні ігри" Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку


































-

Риліна Ірина Олександрівна
19.03.2023 в 12:36
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Назаренко Анастасия
25.02.2021 в 11:55
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Назаренко Анастасия
25.02.2021 в 11:55
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Шевченко Світлана Василівна
26.01.2021 в 20:21
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
Показати ще 1 відгук