Презентація до уроку: "Маса атома. Атомна одиниця маси. Відносні атомні маси хімічних елементів"
Про матеріал
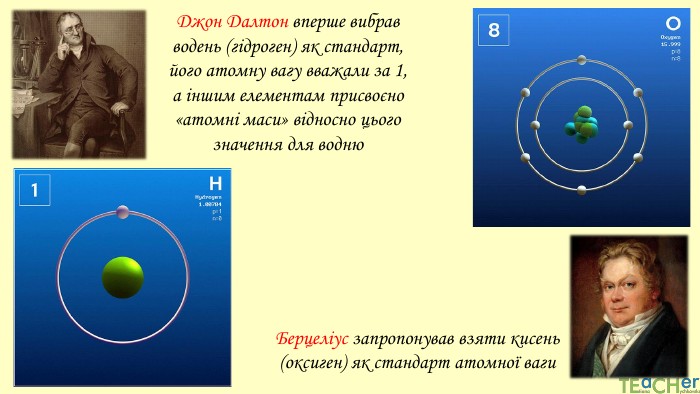
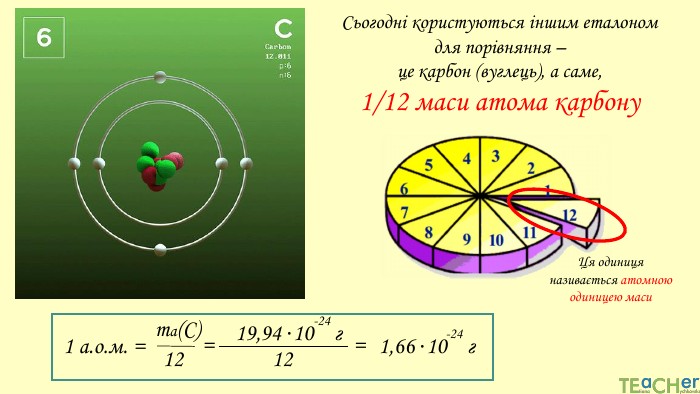
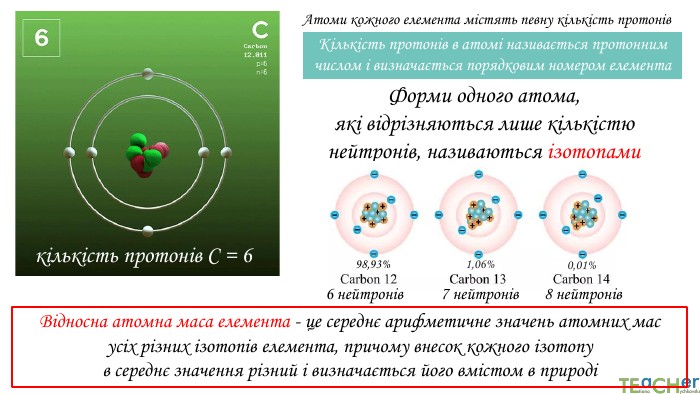
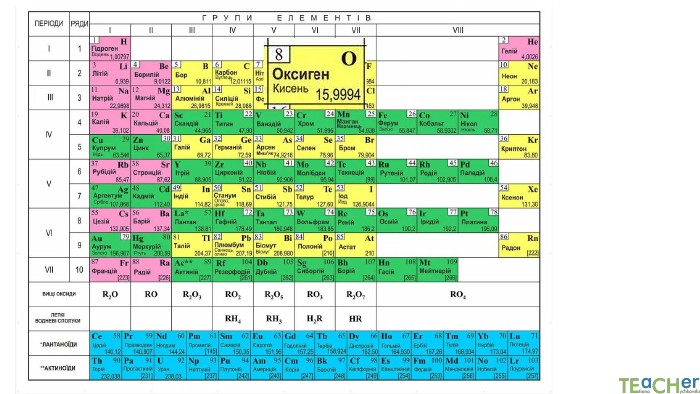
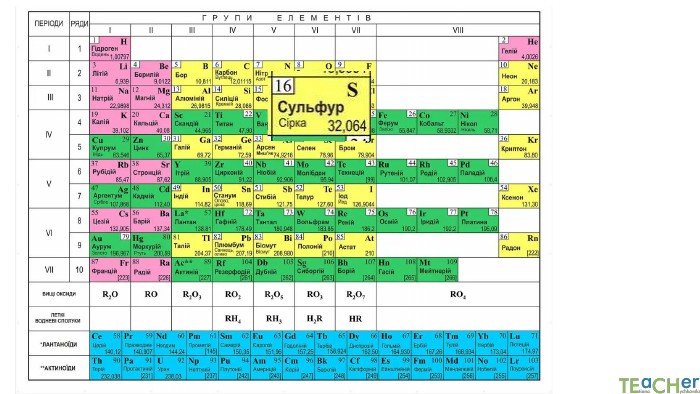
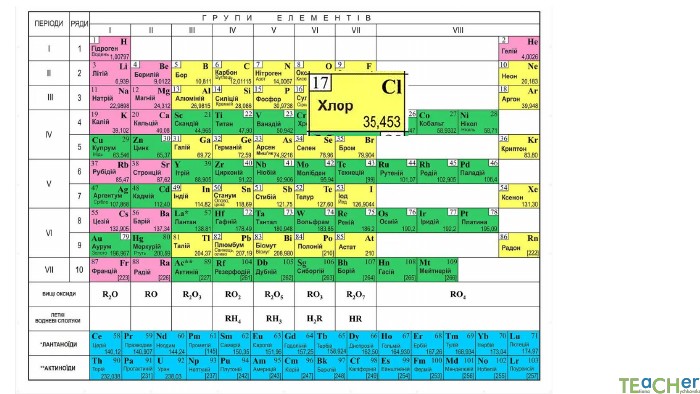
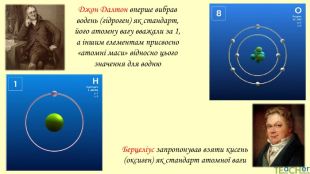
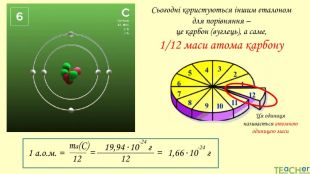
У презентації подано поняття абсолютної атомної маси, атомної одиниці маси, відносної атомної маси хімічного елемента, а також пояснюється, що таке ізотопи і як можна розрахувати відносну атомну масу за вмістом природних ізотопів.
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку





















-

Гордієнко Вікторія
11.03.2024 в 09:54
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Гончарук Світлана Анатоліївна
06.11.2023 в 20:11
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Каленчук Еліна Валентинівна
29.05.2023 в 09:33
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Бакай Анна
12.10.2022 в 22:21
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Пашаєва Тетяна Миколаївна
06.10.2022 в 20:23
Щиро вдячна!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 2 відгука