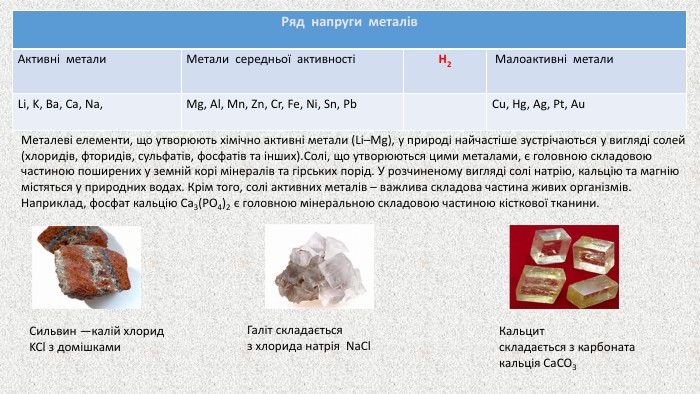
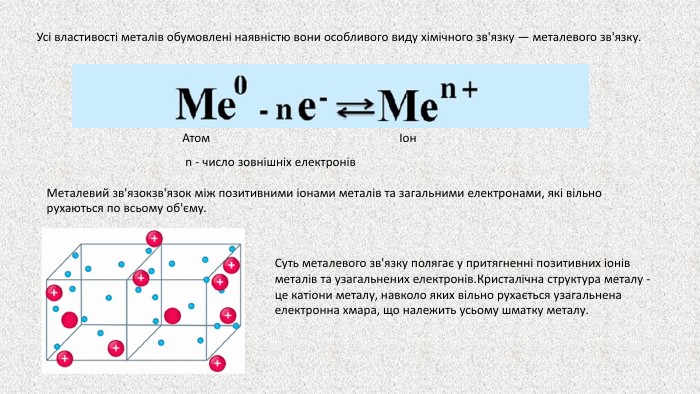
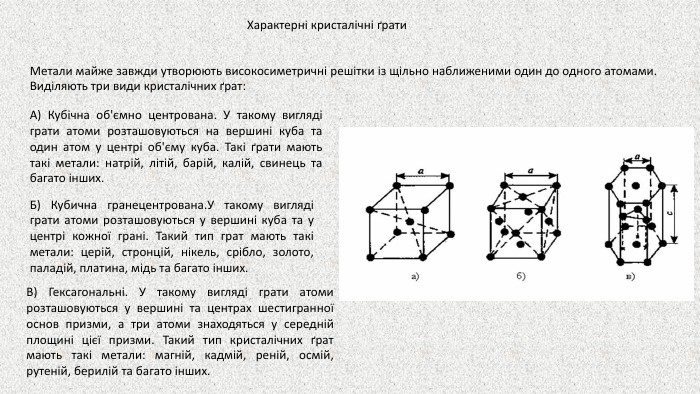
Презентація до уроку на тему "Металічні елементи. Метали"
Про матеріал
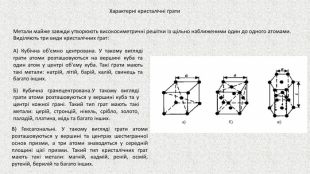
Великий обсяг теми спробувала надати за допомогою мультимедійної презентації, сподіваюсь, мені це вдалось Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку