Презентація на тему "Гідроген хлорид.Гідроген сульфід"
Фізичні властивостіХлороводень HCl безбарвний, термічно стійкий отруйний газ (за нормальних умов) з різким запахом, що димить у вологому повітрі, легко розчиняється у воді (до 500 об'ємів газу на один об'єм води) з утворенням хлороводневої (соляної) кислоти. При -85,1 °C конденсується в безбарвну, рухливу рідину. При −114,22 °C перетворюється на твердий стан. У твердому стані хлороводень існує у вигляді двох кристалічних модифікацій: ромбічної, стійкої нижче -174,75 ° C, і кубічної. Сірководень H2 S - найбільш активне з сірковмісних сполук. У нормальних умовах безбарвний газ із неприємним запахом тухлих яєць. Дуже отруйний: гостре отруєння людини настає вже за концентрацій 0,2–0,3 мг/л, концентрація вище 1 мг/л — смертельна. Сірководень добре розчинний у воді. Діапазон вибухонебезпечних концентрацій суміші з повітрям досить широкий і становить від 4 до 45% про. При контакті з металами (особливо якщо у газі міститься волога) викликає сильну корозію. Найнебажаніший компонент у газах нафтопереробки.
Хімічні властивостіВодний розчин HCl поводиться як сильна одноосновна кислота (ступінь дисоціації понад 90%)HCl <=> H+ + Cl-Соляна кислота реагує з:активними металами – реакція заміщення2 HCl + Zn = Zn. Cl2 + H2 ↑Водний розчин H2 S веде себе як слабка двоосновна кислота. H2 S <=> H+ + HS-HS- <=> H+ + S2-Сульфідна кислота реагує з : основами. H2 S +2 Na. OH = Na2 S+ 2 H2 O
Хімічні властивостіЗ основними та амфотерними оксидами. Ca. O + 2 HCl =Ca. Cl2 +H2 OFe2 O3 + 6 HCl = 2 Fe. Cl3+3 H2 OЗ основами – реакція нейтралізаціїHCl + Na. OH = Na. Cl+ H2 OЗ більшисю солей – реакція обміну. HCl + Ag. NO3 = Ag. Cl ↓ + HNO3 З киснем2 H2 S + О2 = 2 S + 2 H2 O2 H2 S + 3 О2 (надлишок)= 2 SО2 + 2 H2 OС деякими солями. Cu. SO4+H2 S=Cu. S↓+H2 SO4
отримання. В лабораторних умовах можна отримати хлороводень взаємодією розчинів кухонної солі та концентрованої сірчаної кислоти. Na. Cl + H2 SO4 = HCl + Na. HSO4. У промисловості гідроген хлорид отримують прямим синтезом із простих речовин: H2+Cl2= 2 HCl + 184,7 к. Дж. У виробничих умовах синтез здійснюється у спеціальних установках, у яких водень безперервно згоряє рівним полум'ям у струмі хлору, змішуючись з ним безпосередньо у факелі пальника. Тим самим досягається спокійне (без вибуху) перебіг реакції. Водень подається в надлишку (5-10%), що дозволяє повністю використовувати цінніший хлор і отримати незабруднену хлором соляну кислоту.реакція взаємодії розбавлених кислот з сульфідами. Fe. S +2 HCl = Fe. Cl2+ H2 S- реакція взаємодії сульфіду алюмінию з водою. Al2 S3+ 6 H2 O = 3 H2 S + 2 Al(OH)3
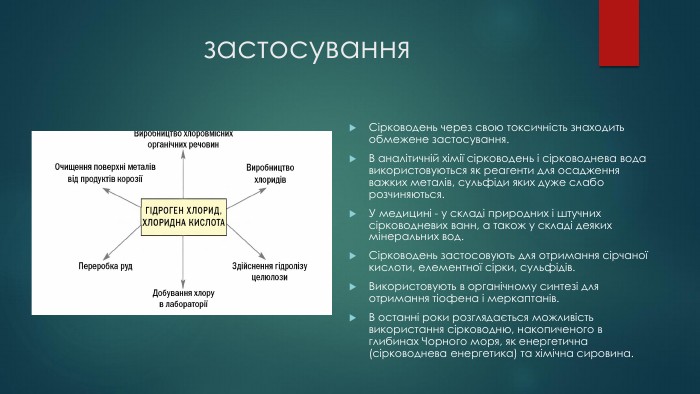
застосування. Сірководень через свою токсичність знаходить обмежене застосування. В аналітичній хімії сірководень і сірководнева вода використовуються як реагенти для осадження важких металів, сульфіди яких дуже слабо розчиняються. У медицині - у складі природних і штучних сірководневих ванн, а також у складі деяких мінеральних вод. Сірководень застосовують для отримання сірчаної кислоти, елементної сірки, сульфідів. Використовують в органічному синтезі для отримання тіофена і меркаптанів. В останні роки розглядається можливість використання сірководню, накопиченого в глибинах Чорного моря, як енергетична (сірководнева енергетика) та хімічна сировина.


про публікацію авторської розробки
Додати розробку