Презентація до уроку: "Поняття про інертні елементи, галогени"
Про матеріал
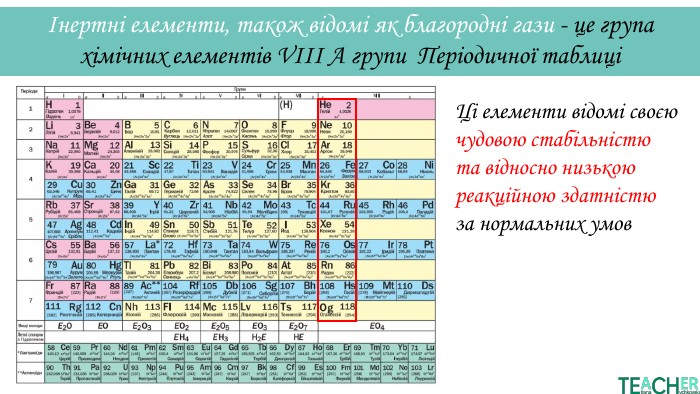
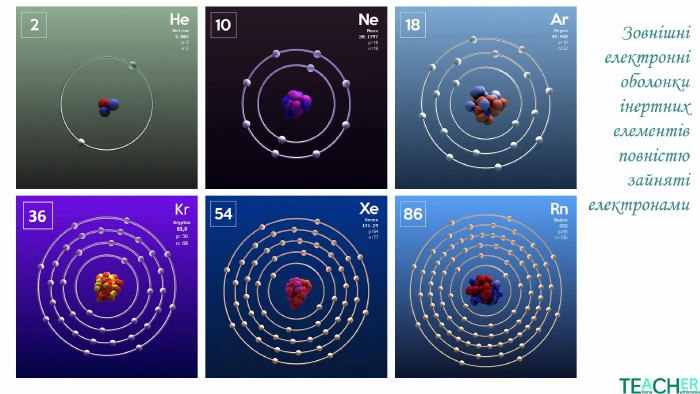
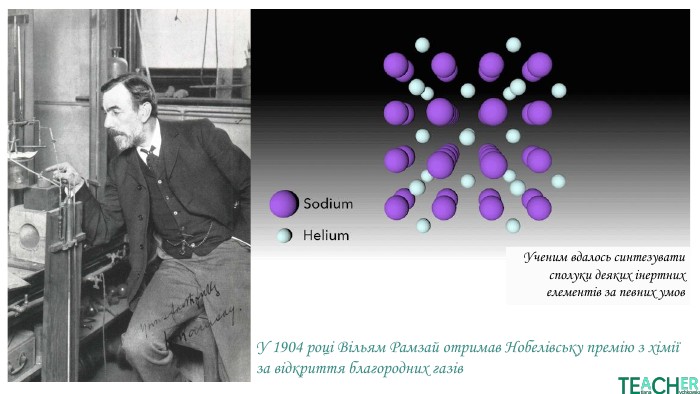
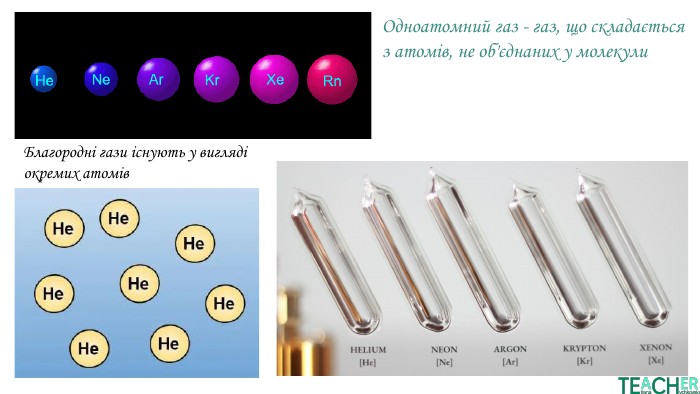
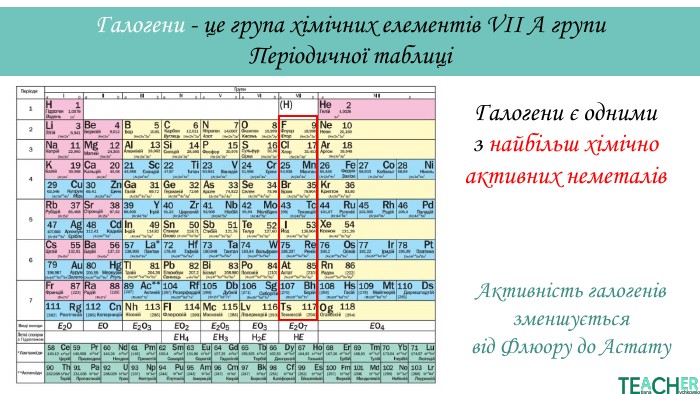
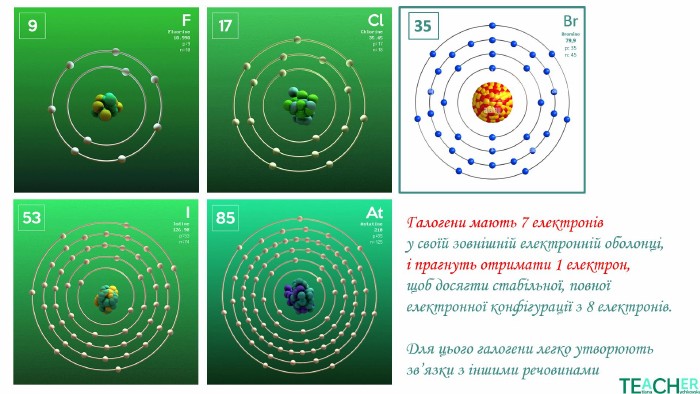
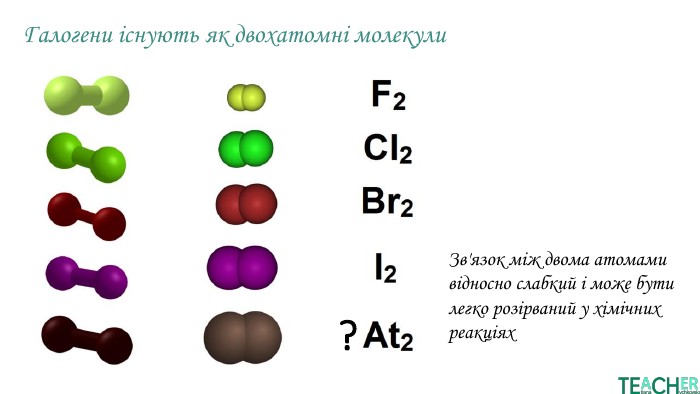
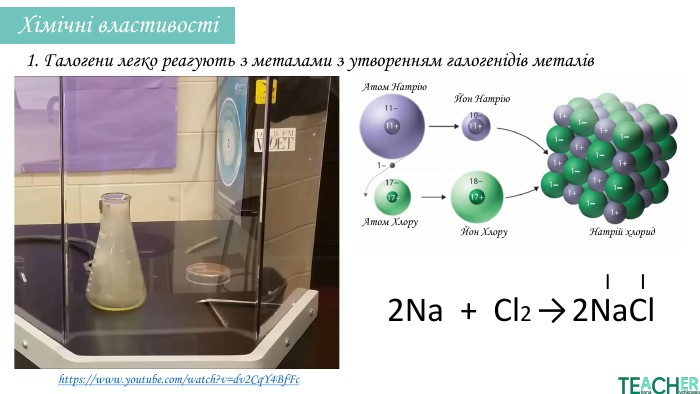
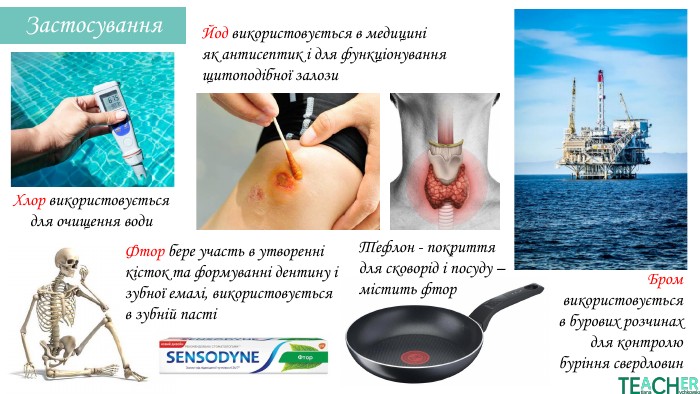
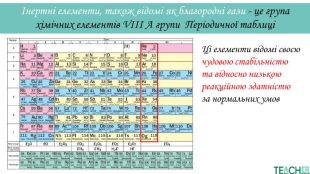
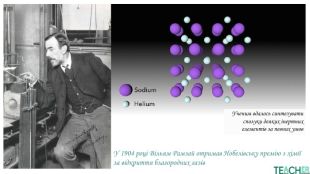
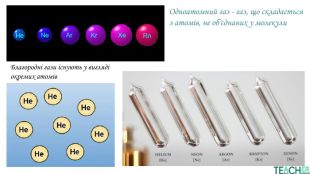
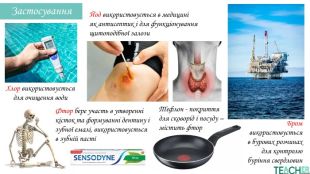
У презентації подано поняття інертних елементів та галогенів, місце у Періодичній системі, особливості будови, фізичні та хімічні властивості, застосування.
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку






























-

Потапова Галина Іванівна
31.01.2025 в 08:22
Дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Гаража Марина Олександрівна
08.11.2023 в 14:15
Дякую!!!
Ви молодець!!!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Дунаєвська Тетяна Іванівна
24.09.2023 в 16:17
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Петрушевська Лілія Дмитрівна
21.09.2023 в 21:49
Загальна:
4.3
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
3.0
-

Хворостяна Вікторія
18.09.2023 в 08:33
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Пашаєва Тетяна Миколаївна
16.09.2023 в 22:17
Дуже дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 3 відгука