Презентація до уроку: "Реакції йонного обміну"
Про матеріал
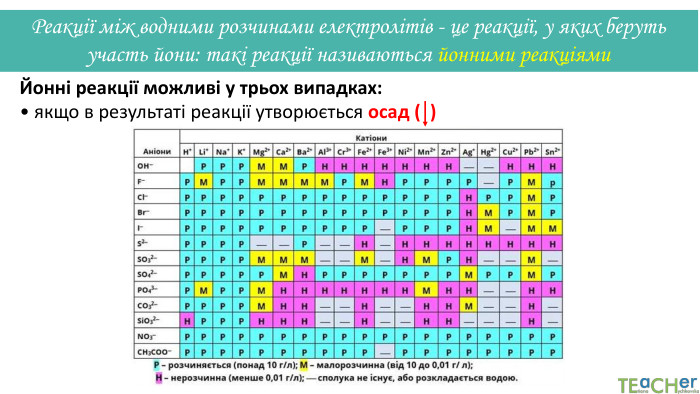
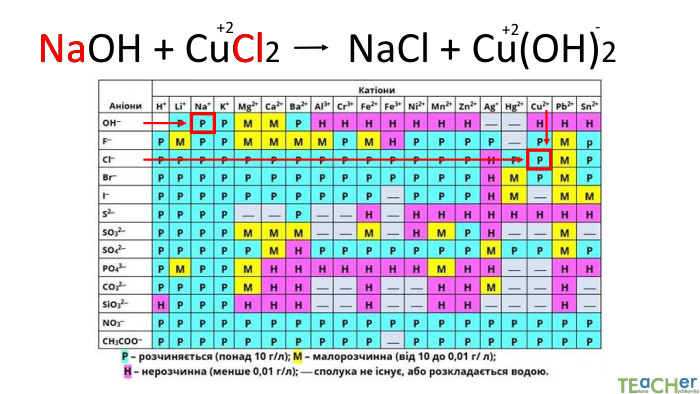
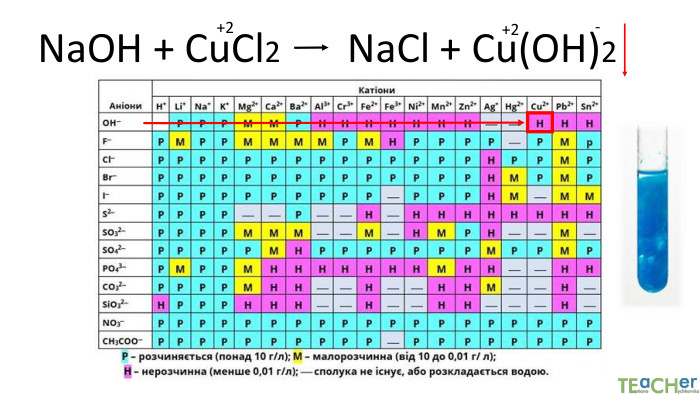
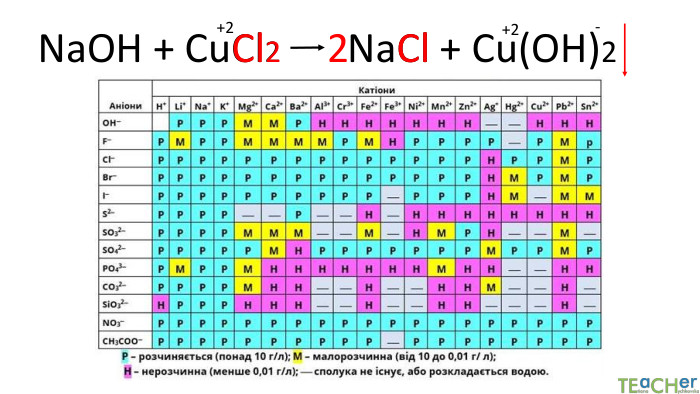
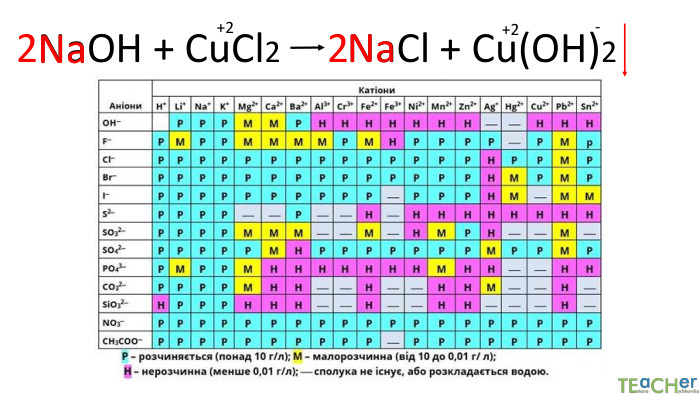
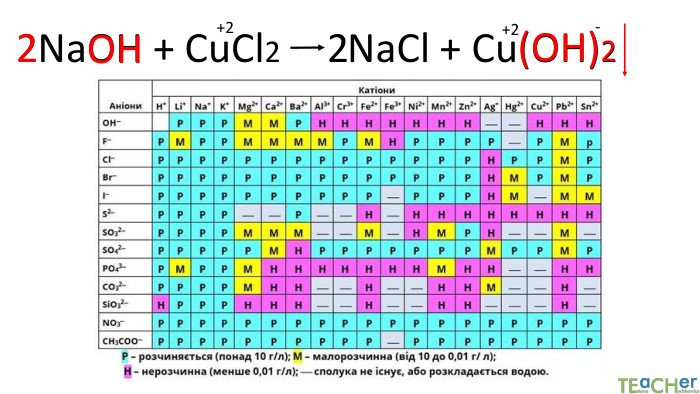
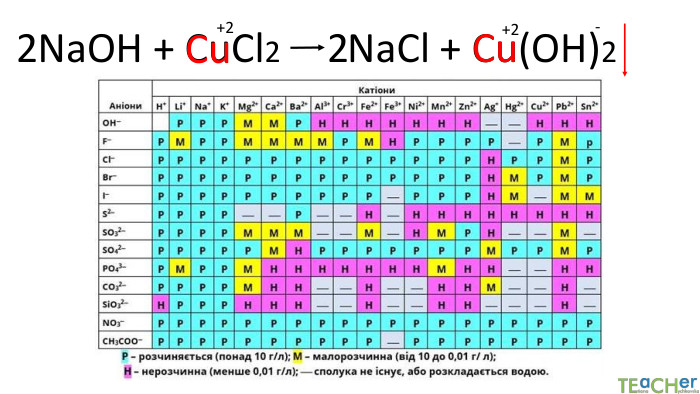
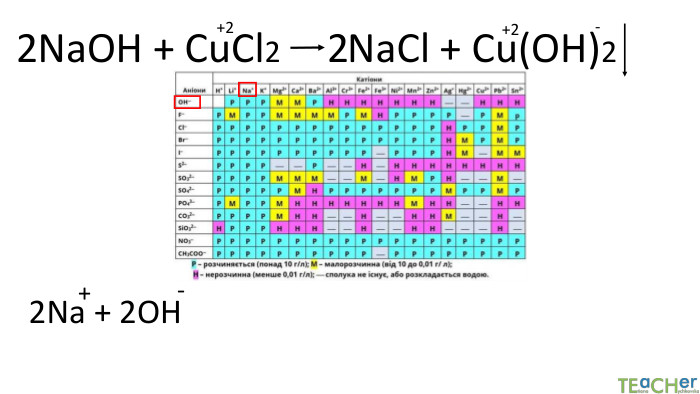
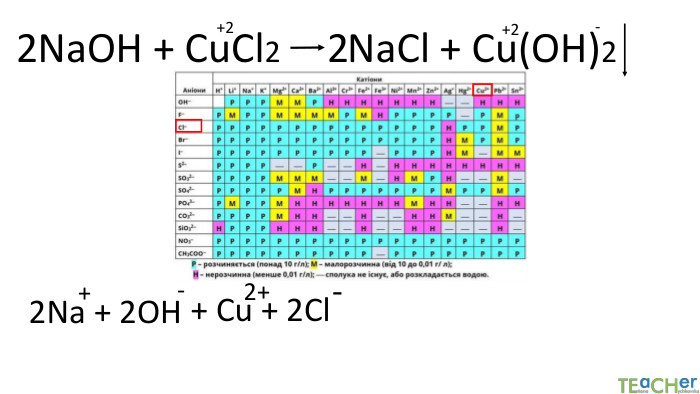
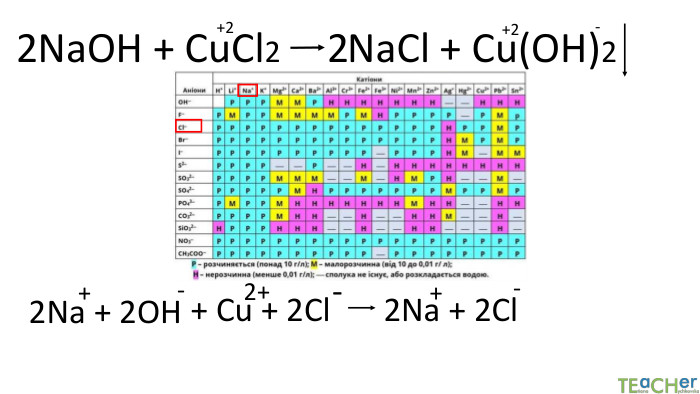
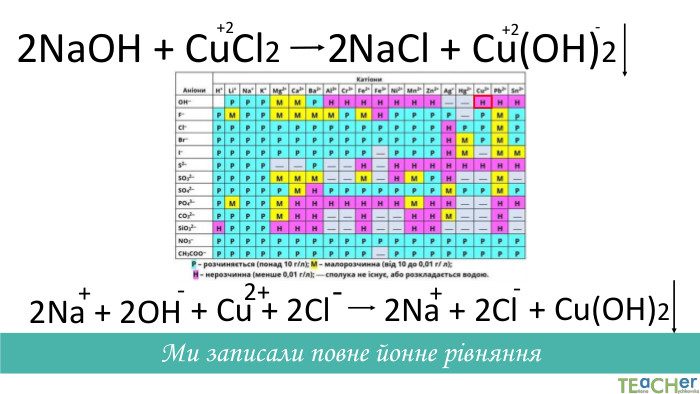
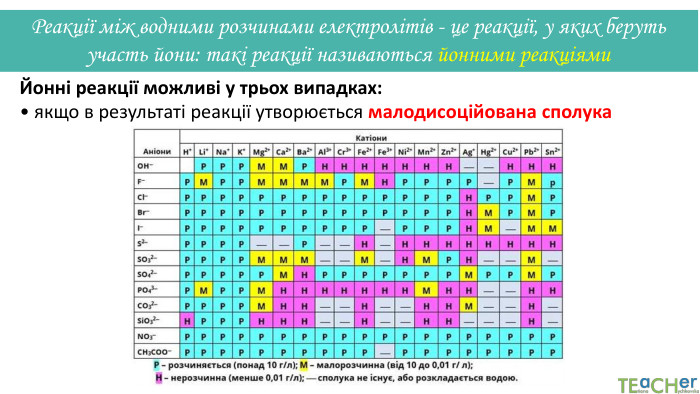
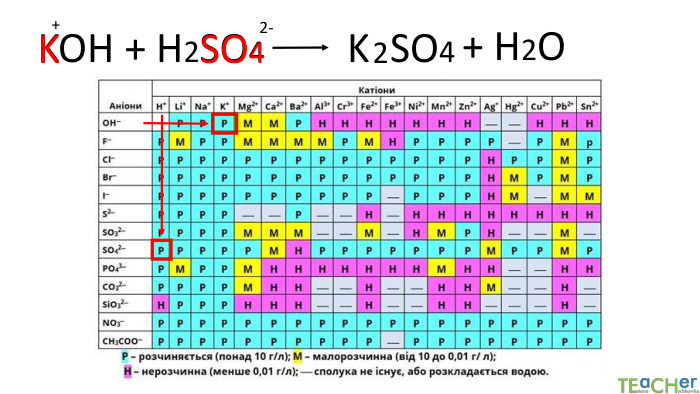
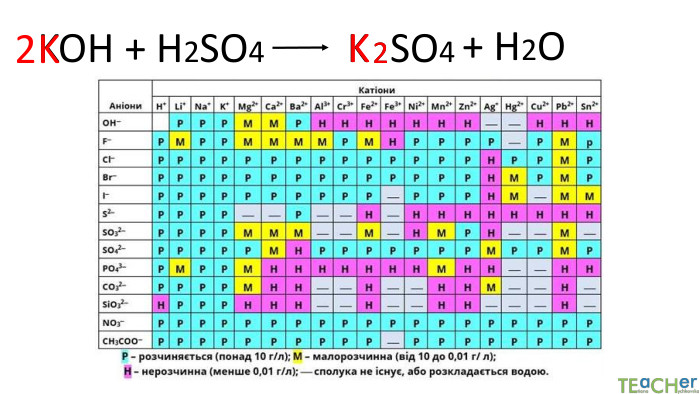
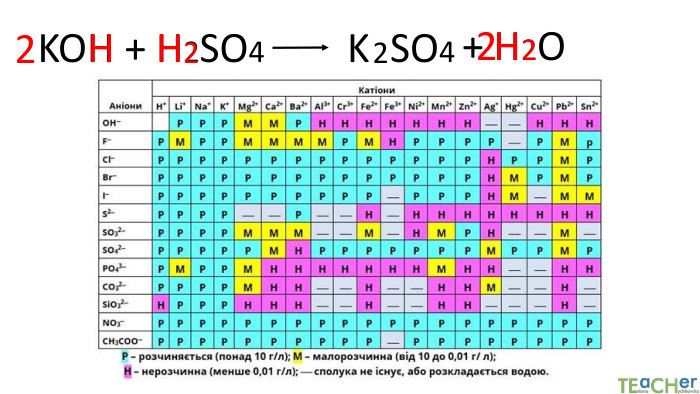
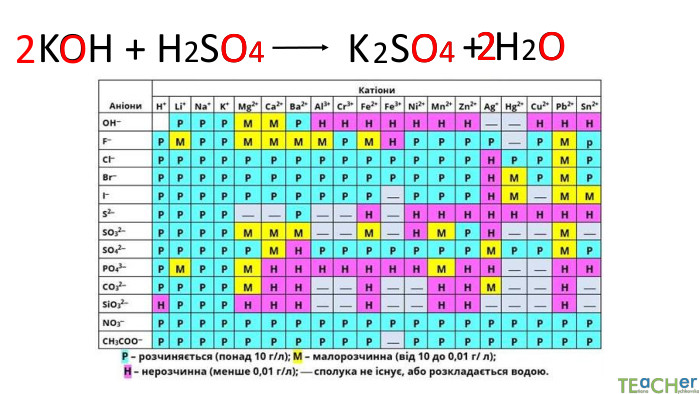
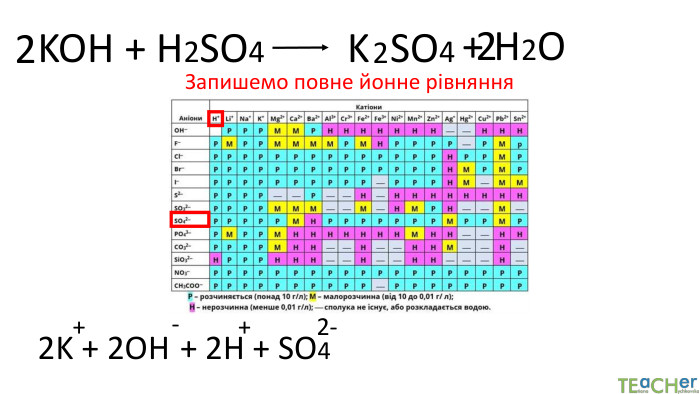
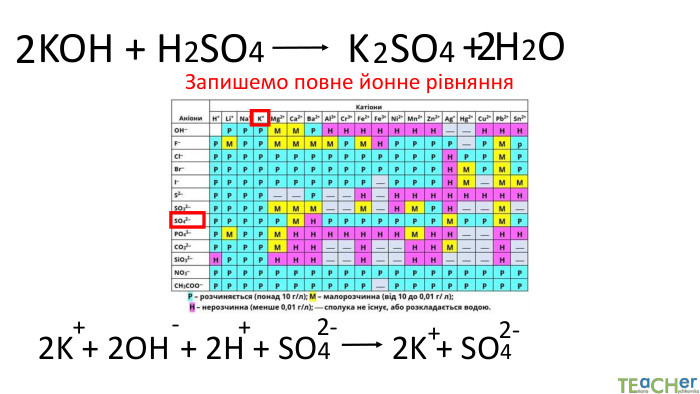
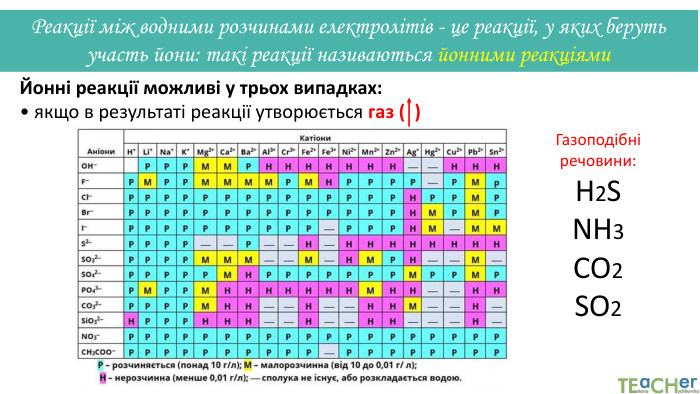
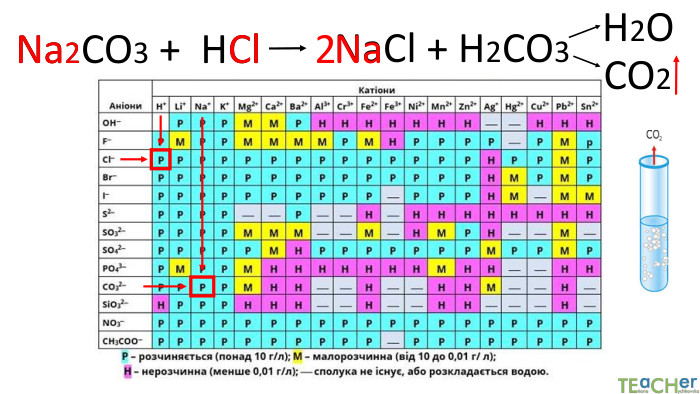
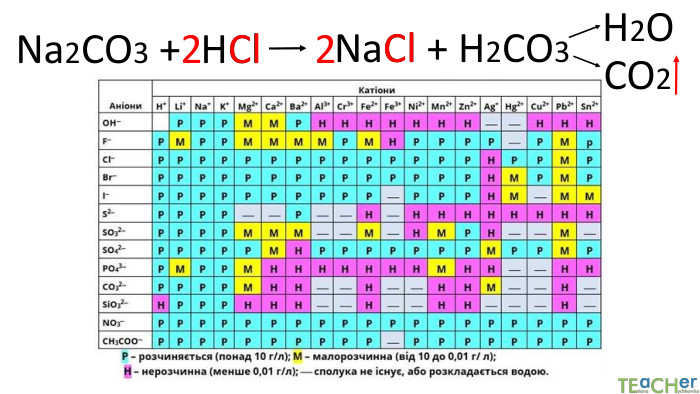
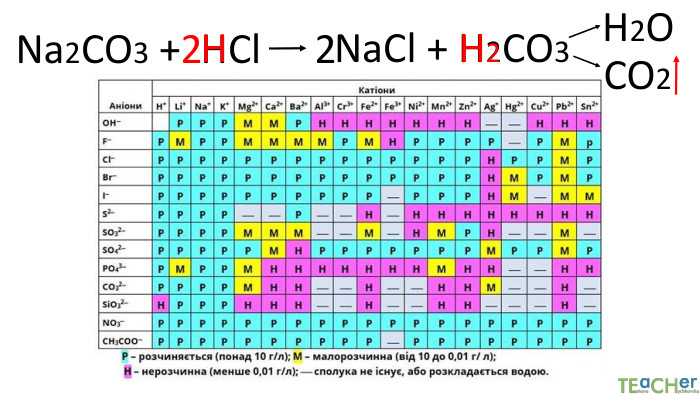
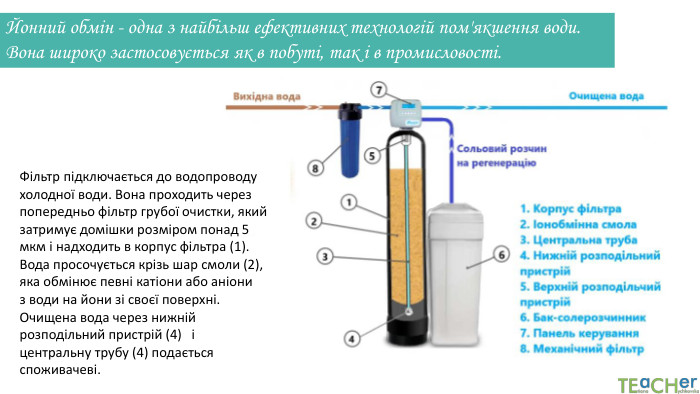
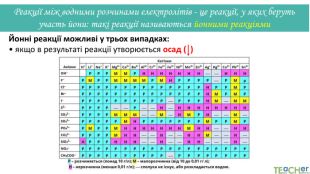
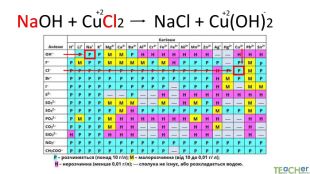
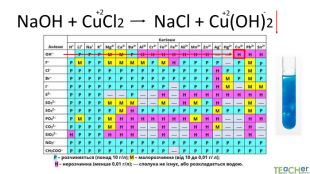
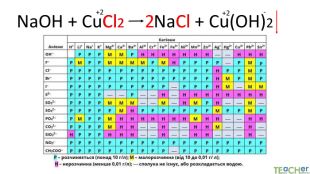
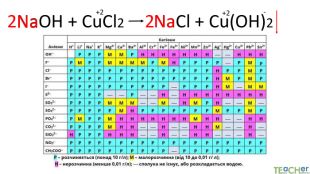
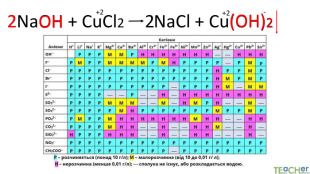
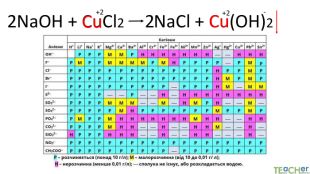
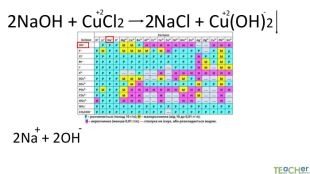
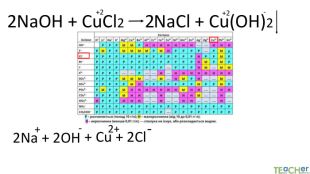
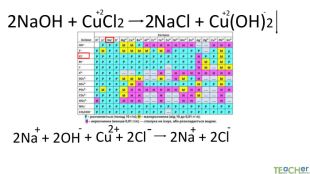
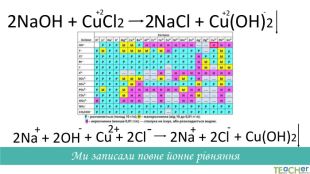
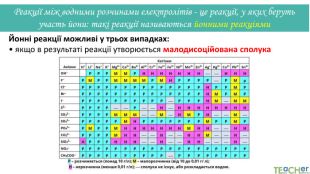
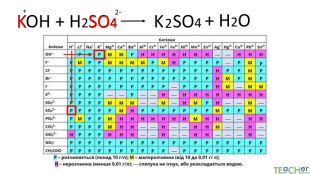
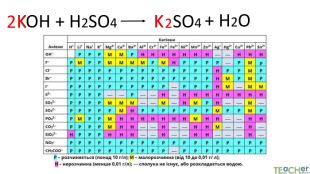
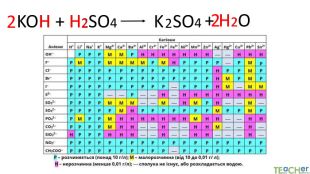
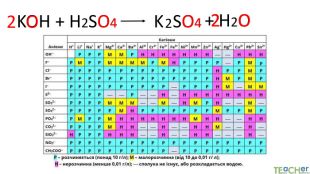
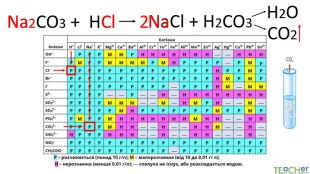
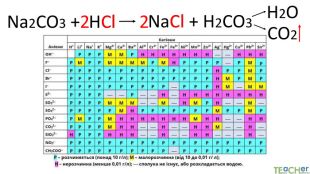
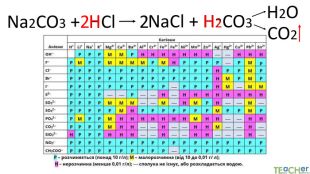
У презентації подано умови проходження реакцій обміну між розчинами електролітів до кінця, матеріал проілюстровано прикладами. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
-
дякую!
-
Дуже вдячна!


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку