Презентація до уроку. "Солі, їх поширення в природі. Середні та кислі солі."
Про матеріал
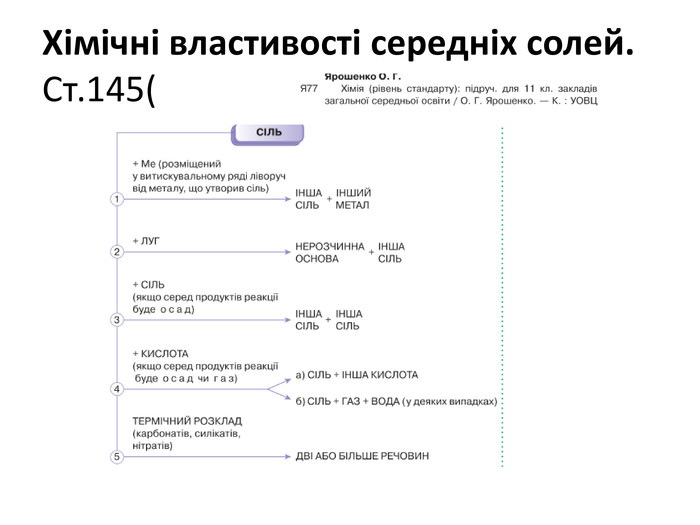
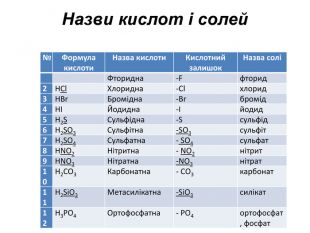
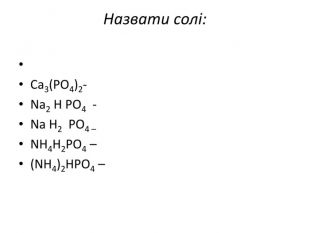
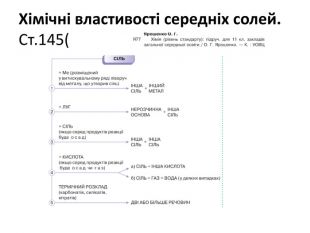
Презентація до уроку хімії в 11 класі "Солі, їх поширення в природі. Середні та кислі солі." Завдання надаються з підручника автора Ярошенко О.Г. Деякі слайди можна використовувати і у 8 класі при вивченні теми " Основні класи неорганічних речовин". Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку