Розробка уроку з хімії в 11 класі по темі: "Алюміній. Фізичні та хімічні властивості."
Тема: Алюміній. Фізичні та хімічні властивості.
Предметні компетентності:
учні складають рівняння реакцій, що підтверджують відновні властивості алюмінію, характеризують фізичні властивості та застосування алюмінію.
Ключові компетентності:
спілкування державною мовою, математична компетентність, основні компетентності у природничих науках і технологіях, інформаційно-цифрова компетентність, екологічна грамотність і здорове життя, уміння вчитися упродовж усього життя.
Хід уроку:
І. Актуалізація опорних знань:
1. Яких елементів — металічних чи неметалічних — більше у 3-му періоді, 4-му періоді?
2. Назвіть групу періодичної системи, в якій розміщені лише металічні елементи.
3. Запишіть електронні формули атома і йона Берилію.
4. Які фізичні властивості є типовими для металів? Поясніть, чому метали проводять електричний струм.
5. Чому найчастіше використовують не самі метали, а їх сплави?
ІІ. Вивчення нового матеріалу:
1. Загальна характеристика хімічного елемента
Алюміній розташований у ІІІА групі. На зовнішньому енергетичному рівні атом Алюмінію містить три електрони, він може лише віддавати електрони, тому стабільний ступінь окиснення Алюмінію у сполуках - +3. Аналізуючи інші елементи ІІІА групи, можна визначити напівметалічність Бору, металічні властивості Галію, що дозволяє припустити проміжні (від металічних до неметалічних) властивості Алюмінію та амфотерність його сполук.
2. Поширеність у природі
Алюміній є найпоширенішим металічним елементом на Землі. Його вміст у земній корі становить 8% (за масою) — це перше місце серед металічних елементів і третє серед усіх елементів. Через високу хімічну активність у вигляді простої речовини Алюміній у природі не трапляється. Він міститься у складі багатьох сполук, які утворюють ґрунти,— глиноземів (Аl2O3) і бокситів (Аl2O3хН2O). Також Алюміній є у складі багатьох мінералів, зокрема коштовного каміння. Різне забарвлення цих мінералів зумовлене невеликими домішками оксидів певних металічних елементів (у рубінів — Сr, у сапфірів — Ті та Fe тощо).
Незважаючи на поширеність у природі, Алюміній не міститься в живих організмах і не бере участі в метаболізмі. В Україні є великі поклади алюмінієвої руди у вигляді бокситів і глинозему в Приазов’ї, на Закарпатті та в межах Українського кристалічного щита — тектонічної смуги, яка простягається вздовж середньої течії Дніпра на відстань понад 1000 км і завширшки 250 км.
3. Будова атома Алюмінію
На зовнішньому енергетичному рівні атома Алюмінію перебувають три електрони:
![]()
![]()
Атом легко їх втрачає, перетворюючись на тризарядний катіон:
![]()
Катіони Алюмінію є складниками більшості сполук елемента.
4. Фізичні властивості алюмінію
• Алюміній — парамагнітний сріблясто-білий метал;
• ковкий, легко витягується в дріт, добре піддається формовці й утворює фольгу;
• tпл. = 660°С, tкип. = 2520 °С;
• належить до групи легких металів, густина 2,7 г/см3;
• виявляє високу тепло- й електропровідність (65 % від електропровідності міді), а також високу світловідбивну здатність.
5. Хімічні властивості алюмінію
Алюміній — дуже активний метал, у ряду активності він розміщений значно лівіше від водню. Але поверхня алюмінію вкрита алюміній оксидом — міцною й тугоплавкою речовиною (tпл. = 2044 °С), унаслідок чого алюміній за звичайних умов не взаємодіє з киснем повітря та водою.
- Взаємодія з киснем.
Алюміній активно взаємодіє з киснем повітря, але реакція відбувається лише на зрізі зразка. Якщо зруйнувати плівку алюміній оксиду на поверхні металу або попередити її утворення нанесенням на поверхню алюмінієвого виробу шару ртуті (амальгами алюмінію), то алюміній досить швидко перетворюється на оксид:
![]()
- Взаємодія з іншими неметалами.
Порошкоподібний алюміній активно взаємодіє з галогенами за звичайних умов, а із сіркою, фосфором та іншими неметалами — за нагрівання. Наприклад, із йодом реакція відбувається за кімнатної температури, але за наявності каталітичної кількості води:
![]()
За різних температурних умов, у деяких випадках із застосуванням каталізаторів, алюміній реагує з великою кількістю неметалів.
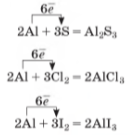
Алюміній реагує з галогенами - фтором, хлором, бромом, йодом. Унаслідок реакцій утворюються відповідні галогеніди Алюмінію:
![]()
Горіння алюмінію в хлорі супроводжується виділенням теплової та світлової енергії. Після закінчення реакції колбу заповнює дим - розпорошений алюміній хлорид. Так само бурхливо відбувається реакція алюмінію з бромом. Реакція алюмінію з йодом каталітична. Аби вона почалася, достатньо добавити кілька крапель води до суміші алюмінієвого порошку з йодом.
- Взаємодія з кислотами.
Як і всі активні метали, алюміній витісняє водень із розбавлених розчинів кислот:
![]()
За нагрівання алюміній взаємодіє з концентрованими кислотами-окисниками (холодна нітратна кислота пасивує алюміній):
![]()
- Взаємодія з лугами. Алюміній витісняє водень із розчинів лугів:
![]()
![]()
- Відновлення металів (алюмотермія).
Алюміній — активний метал, тому витісняє інші метали з їхніх сполук, зокрема з оксидів. Ці реакції використовують для одержання деяких металів алюмотермічним способом:
![]()
![]()
6. Застосування алюмінію
• У великих кількостях алюміній використовують у металургії для одержання інших менш активних металів методом алюмотермії.
• Алюміній є цінним конструкційним матеріалом. Він відносно легкий (густина алюмінію набагато менша за густину сталі), але досить міцний. Тому з алюмінію виготовляють легкі й довговічні будівельні конструкції
• Багато алюмінію потребує авіаційна промисловість. Дюралюмінієм обшивають корпуси літаків.
• Пилоподібний алюміній та деякі його сполуки використовують як тверде ракетне пальне. • Алюміній легко піддається штамповці, він стійкий до корозії, а його сполуки нетоксичні. Завдяки цьому з алюмінію виготовляють столові прибори, посуд, бляшанки, кухонні гаджети.
• Через свою високу відбивну здатність та легкість напилення алюміній є ідеальним матеріалом для виготовлення дзеркал.
• Суміш алюмінію з ферум(ІІІ) оксидом — терміт — використовують для зварювання залізничних рейок та труб.
ІІІ. Узагальнення й систематизація знань:
1. Схарактеризуйте хімічну активність алюмінію.
2. Чим ви поясните, що Алюміній має ступінь окиснення +3, а не, приміром, +2 чи -5?
3. Зважаючи на хімічні властивості алюмінію, сформулюйте поради щодо використання алюмінієвого кухонного посуду.
4. Де в промисловості застосовують відновні властивості алюмінію?
5. Схарактеризуйте хімічний елемент Алюміній та фізичні властивості утвореної ним простої речовини.
6. Чому не можна тримати луги в алюмінієвій тарі?
7. Користуючись рядом активності металів, розташуйте метали мідь, натрій, алюміній за зростанням хімічної активності.
8. Напишіть хімічні рівняння за схемою перетворень:

9. Сплав міді й алюмінію масою 15 г обробили надлишком хлоридної кислоти й добули водень об’ємом 13,44 л (н. у.). Обчисліть масові частки металів у сплаві.
10. На початку XX ст. взаємодією алюмінію з розчином лугу добували водень, яким заповнювали дирижаблі. Обчисліть відносний вихід водню об’ємом 295,68 л (н. у.), для добування якого було взято алюміній масою 270 г.
11. Допишіть схеми реакцій і перетворіть їх на хімічні рівняння:
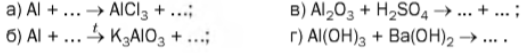
12. Знайдіть масову частку алюміній оксиду в мінералі беміті АІО(ОН).
13. Наведіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
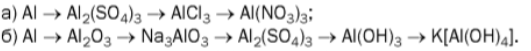
14. Обчисліть масу Алюмінію в 48,3 г кристалогідрату АІСІ3 • 6Н2О.
15. У якому об’ємі води потрібно розчинити 7,5 г кристалогідрату AI(NО3)3 • 9Н2О, щоб приготувати розчин із масовою часткою безводної солі 7,1 %?
16. Під час взаємодії суміші алюмінію та магнію з надлишком хлоридної кислоти виділилося 8,96 л газу, а при дії надлишку розчину лугу на таку саму порцію суміші металів добуто 3,36 л цього газу. Обчисліть масові частки металів у суміші, якщо об’єми газу виміряно за нормальних умов.
17. Склад бокситу можна описати формулою АІ20 3-ЗН20, а склад глини — AI20 3-2Si02-2H20. У якій речовині масова частка Алюмінію більша?
18. Суміш порошків алюмінію й міді масою 20 г обробили розбавленим розчином сульфатної кислоти. Під час реакції виділився водень об'ємом 6,72 л (н. у.). Обчисліть масові частки металів у суміші.
19. Обчисліть масу бокситу AI2О3 • 3Н2О, що містить 20 % домішок, яка необхідна для одержання алюмінію масою 10,8 кг.
20.Обчисліть масу алюмінію, яку можна добути з алюміній оксиду масою 51 кг. Вихід продукту реакції від теоретично можливого становить 95 %.
21. Виконайте навчальний проект «Крилатий метал», у якому розкрийте:
а) властивості, що зумовлюють широке використання алюмінію в різних галузях господарства, військовій справі, побуті;
б) виробництво алюмінію в Україні;
в) використання сплавів алюмінію;
г) продукцію вітчизняних виробників, що містить алюміній.
ІV. Домашнє завдання:


про публікацію авторської розробки
Додати розробку
