Презентація до уроку: "Валентність хімічних елементів. Складання формули бінарної сполуки за валентністю"


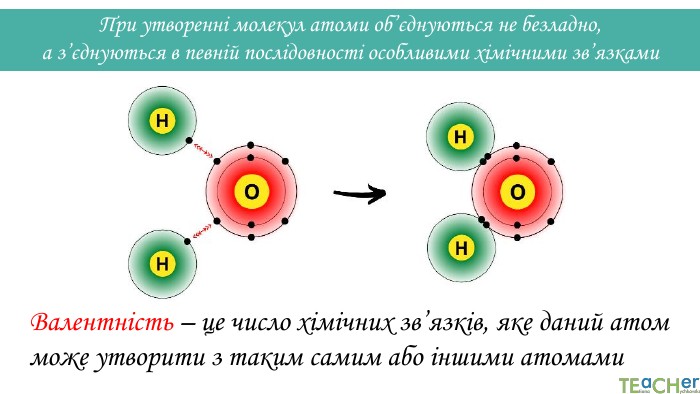


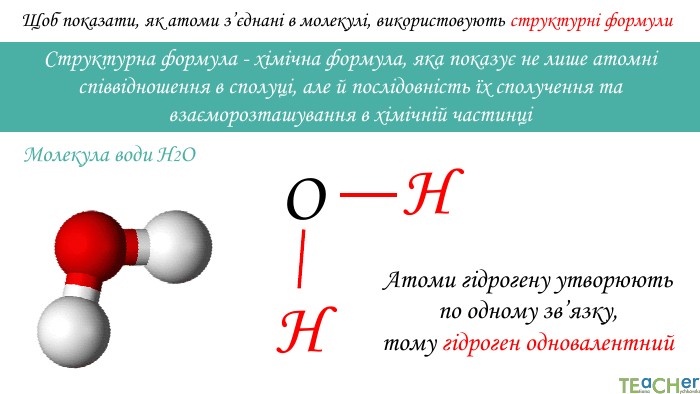

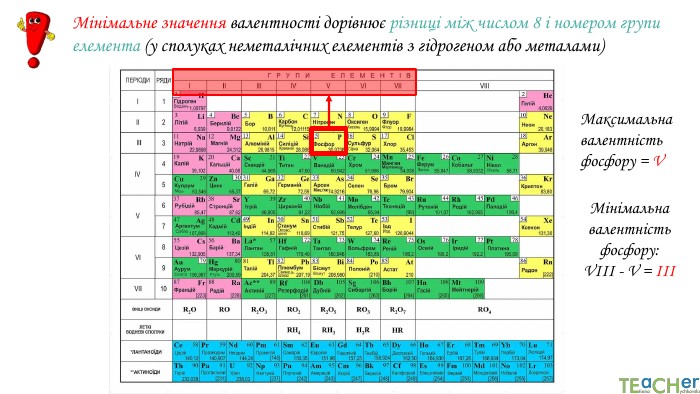
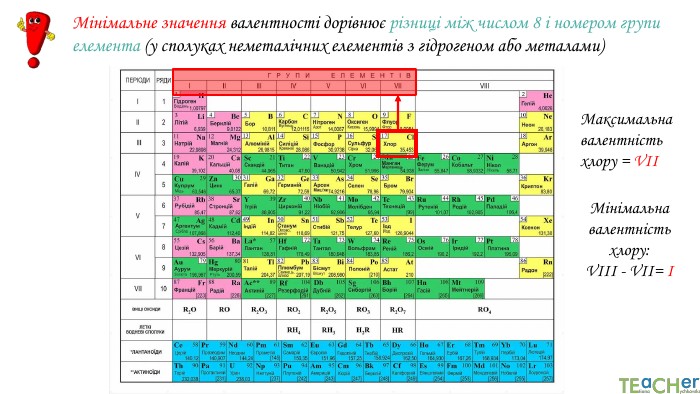
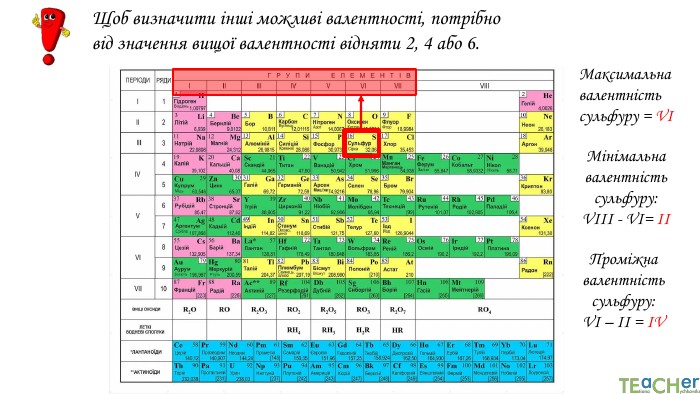
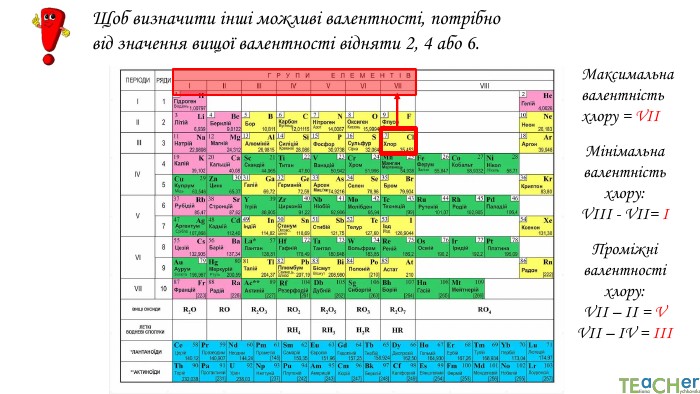















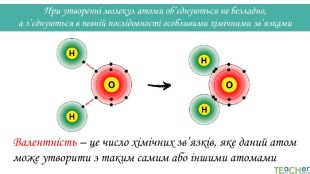
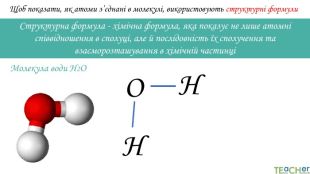
Щоб показати, як атоми з’єднані в молекулі, використовують структурні формули. Структурна формула - хімічна формула, яка показує не лише атомнi спiввiдношення в сполуцi, але й послідовність їх сполучення та взаєморозташування в хімічній частинціННОАтом оксигену утворює два зв’язки, тому оксиген двовалентний. Молекула води Н2 О
Щоб показати, як атоми з’єднані в молекулі, використовують структурні формули. Структурна формула - хімічна формула, яка показує не лише атомнi спiввiдношення в сполуцi, але й послідовність їх сполучення та взаєморозташування в хімічній частинціННОАтоми гідрогену утворюють по одному зв’язку, тому гідроген одновалентний. Молекула води Н2 О
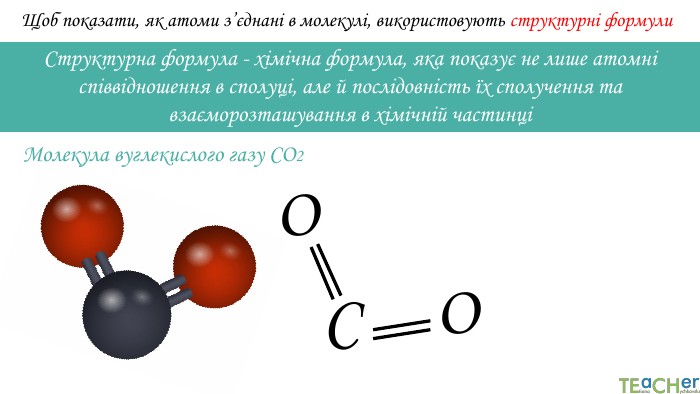
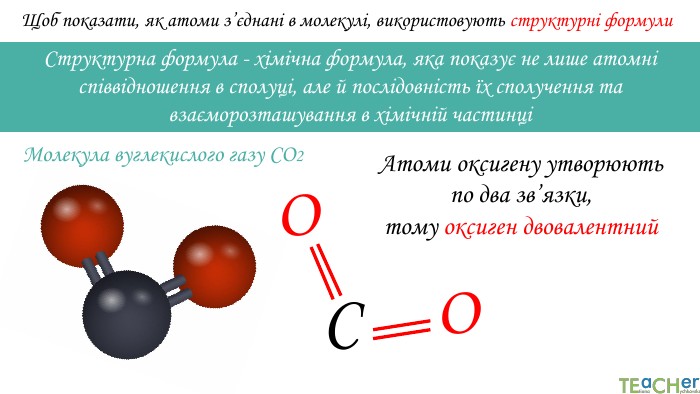
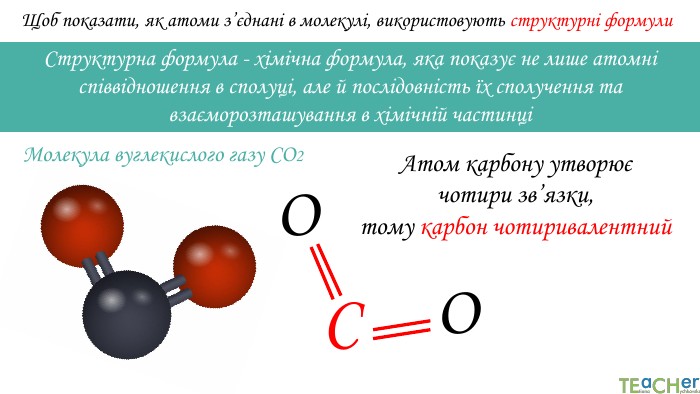
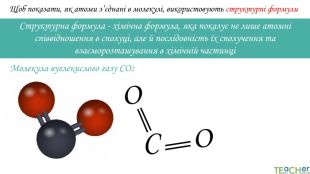
Щоб показати, як атоми з’єднані в молекулі, використовують структурні формули. Структурна формула - хімічна формула, яка показує не лише атомнi спiввiдношення в сполуцi, але й послідовність їх сполучення та взаєморозташування в хімічній частинціООСАтоми оксигену утворюють по два зв’язки, тому оксиген двовалентний. Молекула вуглекислого газу СО2
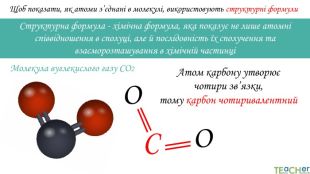
Щоб показати, як атоми з’єднані в молекулі, використовують структурні формули. Структурна формула - хімічна формула, яка показує не лише атомнi спiввiдношення в сполуцi, але й послідовність їх сполучення та взаєморозташування в хімічній частинціООСАтом карбону утворює чотири зв’язки, тому карбон чотиривалентний. Молекула вуглекислого газу СО2
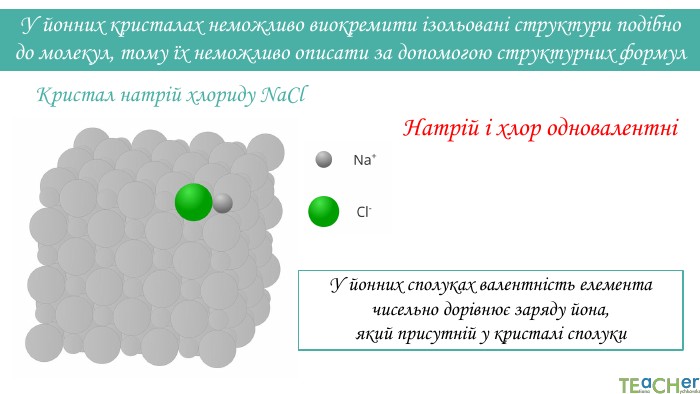
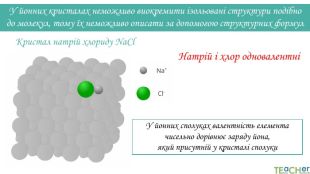
У йонних кристалах неможливо виокремити ізольовані структури подібно до молекул, тому їх неможливо описати за допомогою структурних формул. Натрій і хлор одновалентніКристал натрій хлориду Na. Cl. У йонних сполуках валентність елемента чисельно дорівнює заряду йона, який присутній у кристалі сполуки
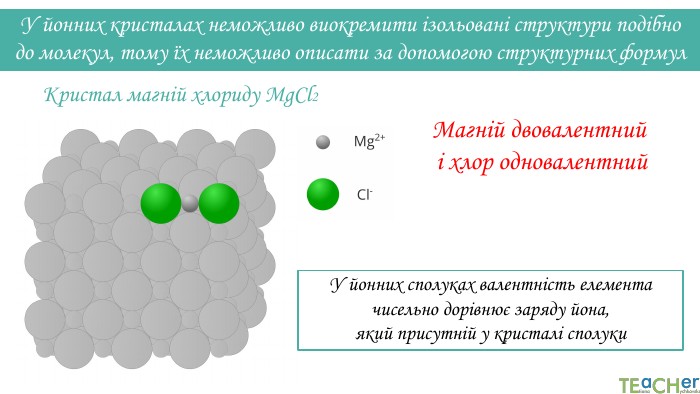
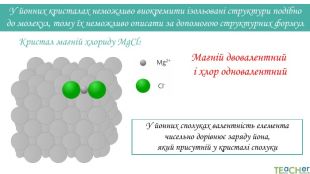
Магній двовалентний і хлор одновалентний. Кристал магній хлориду Mg. Cl2 У йонних кристалах неможливо виокремити ізольовані структури подібно до молекул, тому їх неможливо описати за допомогою структурних формул. У йонних сполуках валентність елемента чисельно дорівнює заряду йона, який присутній у кристалі сполуки
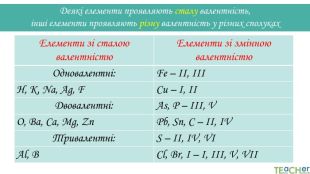
Деякі елементи проявляють сталу валентність, інші елементи проявляють різну валентність у різних сполуках{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}Елементи зі сталою валентністю. Елементи зі змінною валентністю. Одновалентні: Fe – II, IIIH, K, Na, Ag, FCu – I, IIДвовалентні: As, P – III, VO, Ba, Ca, Mg, Zn. Pb, Sn, C – II, IVТривалентні: S – II, IV, VIAl, BCl, Br, I – I, III, V, VII
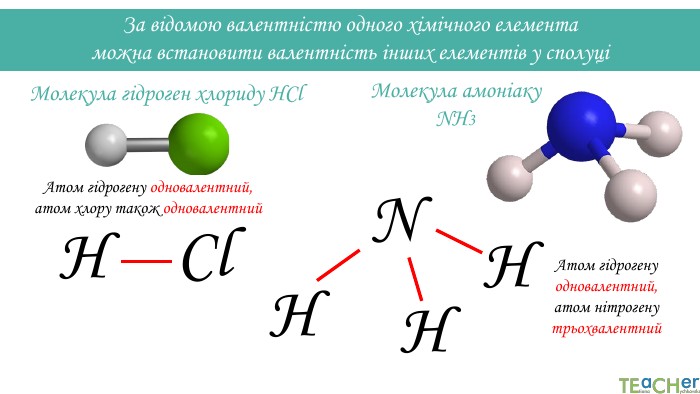
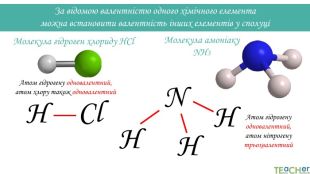
За відомою валентністю одного хімічного елемента можна встановити валентність інших елементів у сполуціМолекула гідроген хлориду HCl. Атом гідрогену одновалентний, атом хлору також одновалентний. Cl. НМолекула амоніаку NH3 Атом гідрогену одновалентний, атом нітрогену трьохвалентний. НННN
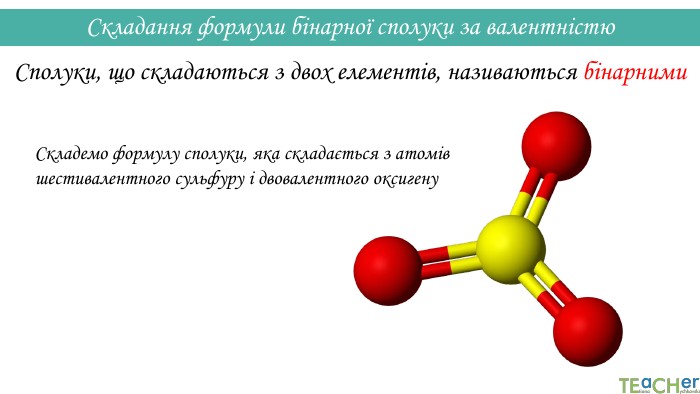
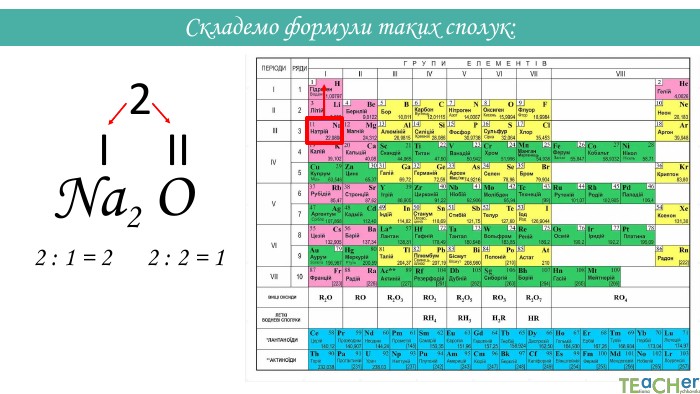
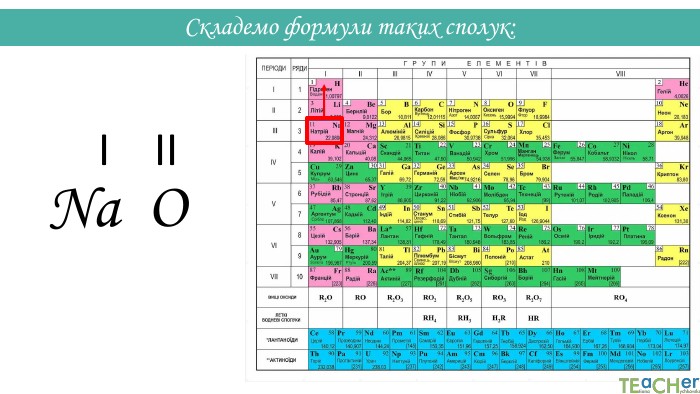
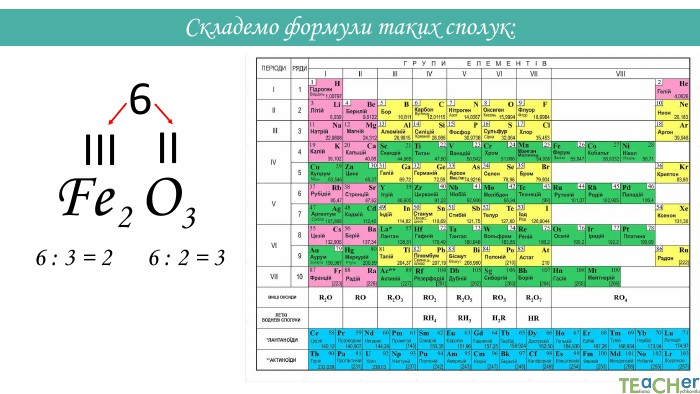
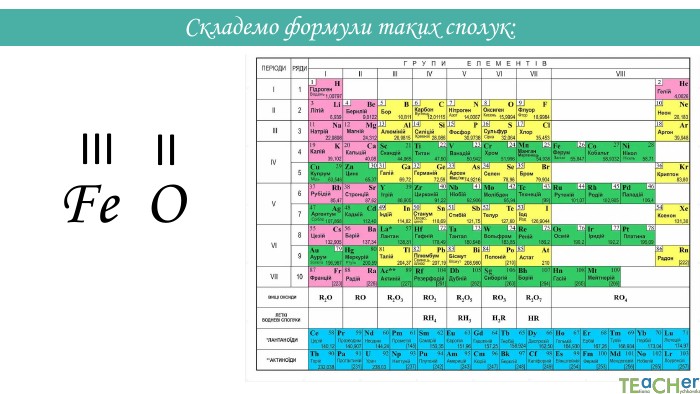
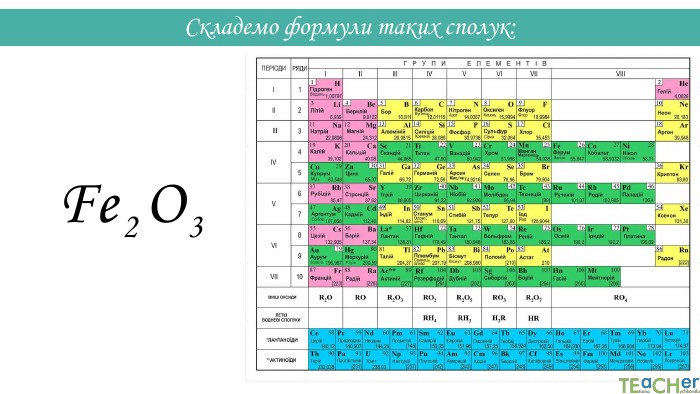
Складання формули бінарної сполуки за валентністю. Сполуки, що складаються з двох елементів, називаються бінарними. Аглоритм складання формул. Перший спосіб. SO1. Записуємо символи у необхідному порядку і надписуємо їхню валентність: На першому місці пишеться символ того елемента, який у періодичній системі розташований лівіше або нижче(винятки: NH3, PH3, Si. H3)IIVІ
Назви бінарних сполук: Назва бінарних сполук складається з двох слів: перше слово – назва першого елемента сполуки, друге слово – основа другого елемента сполуки + суфікс -ід (-ид). Якщо перший елемент має змінну валентність, після його символа у дужках вказується валентність. Н2 О - гідроген оксид. СО2 - карбон (IV) оксид. Mg. Cl2 - магній хлорид. K2 S - калій сульфід
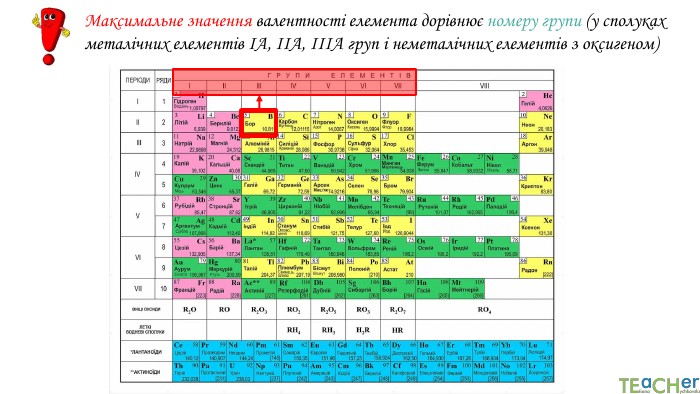
Підіб’єм підсумки!1. Валентність – це число хімічних зв’язків, яке даний атом здатний утворити з іншими атомами.2. Валентність гідрогену дорівнює І, оксигену – ІІ, флуору – І.3. Максимальна валентність елемента дорівнює номеру групи, мінімальна – для неметалів дорівнює різниці числа 8 і номеру групи, у якій стоїть елемент.4. У формулах бінарних сполук на першому місці ставлять символ елементів, які у періодичній системі розміщені лівіше або нижче, на другому – які правіше або вище (винятки: NH3, PH3, Si. H3).


про публікацію авторської розробки
Додати розробку
































-

Шатовський Валентин Олександрович
11.11.2023 в 06:31
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Товстолес Лариса
16.10.2023 в 20:26
Дякую за чудову роботу!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Дудуш Яна
16.08.2023 в 19:28
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Васильчук Віра
20.11.2022 в 08:16
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Виноградова Оксана Михайлівна
15.11.2022 в 23:30
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Воронівська Наталья Гуріївна
13.11.2022 в 19:04
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Пашаєва Тетяна Миколаївна
23.10.2022 в 18:17
Дуже дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 4 відгука