Презентація до уроку: "Відносна густина газів"
Про матеріал
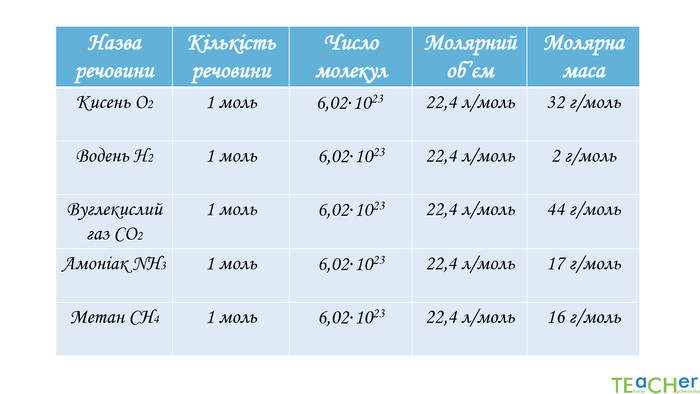
У презентації подано поняття густини, відносної густини газів та розвязування типових задач із використанням поняття відносної густини газів. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку























-

Тихончук Олександр
21.01.2024 в 21:23
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Тимчишин Іванна
12.01.2024 в 13:44
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Петренко Наталія
11.12.2023 в 12:17
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Крамар Світлана
12.02.2023 в 22:13
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Павлова Надія Олександрівна
26.01.2023 в 21:03
У презентації (слайд 3) допущена неточність: густина газу НЕ дорівнює його молярній масі. Треба вказати, що відносна густина одного газу за іншим визначається за молярною масою.
Загальна:
3.7
Структурованість
4.0
Оригінальність викладу
3.0
Відповідність темі
4.0
-

Коханова Ольга Олексіївна
24.01.2023 в 09:25
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Переверзева Інна Євгенівна
22.01.2023 в 09:01
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Товстолес Лариса
18.01.2023 в 21:05
Дякую.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Воронівська Наталья Гуріївна
09.01.2023 в 23:16
Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Клюй Татьяна
07.12.2022 в 19:50
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

ляшук лілія
08.02.2022 в 22:26
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Дзевенко Марія Віталіївна
08.02.2022 в 11:48
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Раєва Алла Фахраддинівна
31.01.2022 в 22:10
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Сенецька Оксана Анатоліївна
30.01.2022 в 16:44
Дякую!!!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

М'якотіна Юлія Ярославлівна
29.01.2022 в 20:30
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Максименко Ірина Василівна
27.01.2022 в 08:37
Дуже гарна презентація! Ви молодець!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Франчук Мар'яна Віталіївна
23.01.2022 в 23:27
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Тихонова Віка
18.01.2022 в 08:12
Дуже гарна презентація!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Крамар Лариса
13.07.2021 в 13:30
Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Моренко Марина Георгіївна
28.01.2021 в 15:01
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

фертак наталя
21.01.2021 в 19:38
Дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 18 відгуків