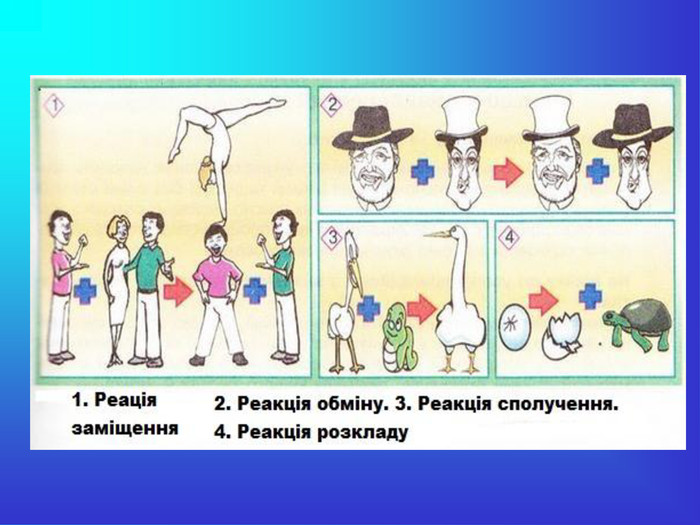
Презентація до узагальнюючого уроку "Хімічні реакції"
Про матеріал
Презентація до узагальнюючого уроку "Хімічні реакції". Метою якої є візуально доповнити урок, економити час під час виконання завдань та перевірки результатів.Більшість слайдів містять інформацію про завдання, які повинні виконуватися учнями на уроці. Слайди №№8,18,19,20 містять відповіді на завдання і дають можливість швидко організувати перевірку знань учнів, вказати на помилки.
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Цікава, творча робота. Дякую, використаю на уроці.

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку