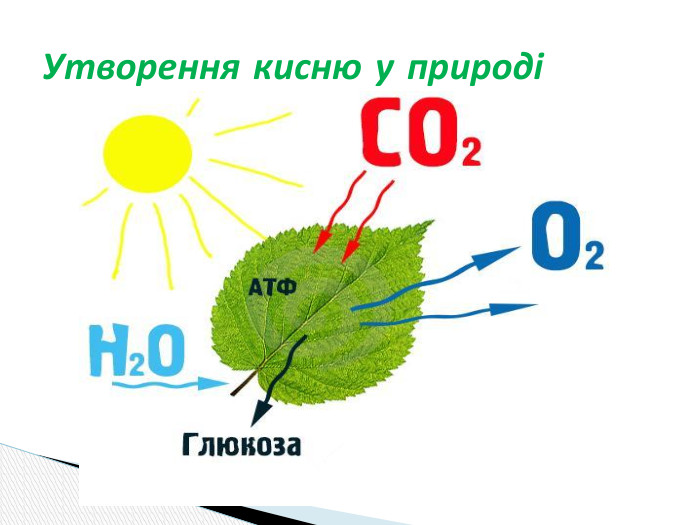
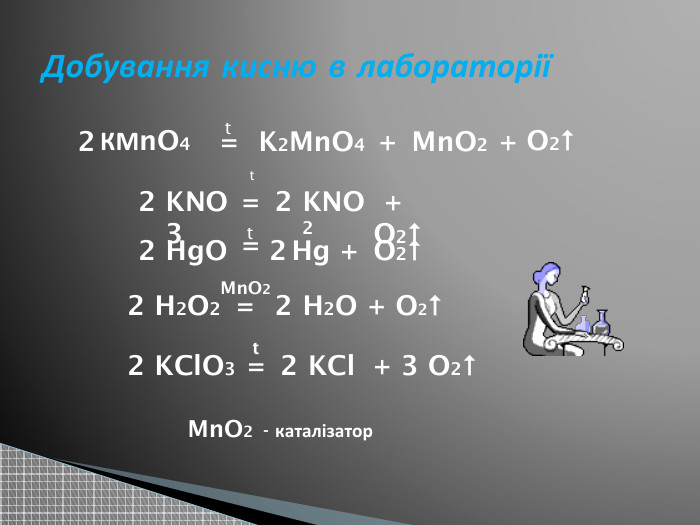
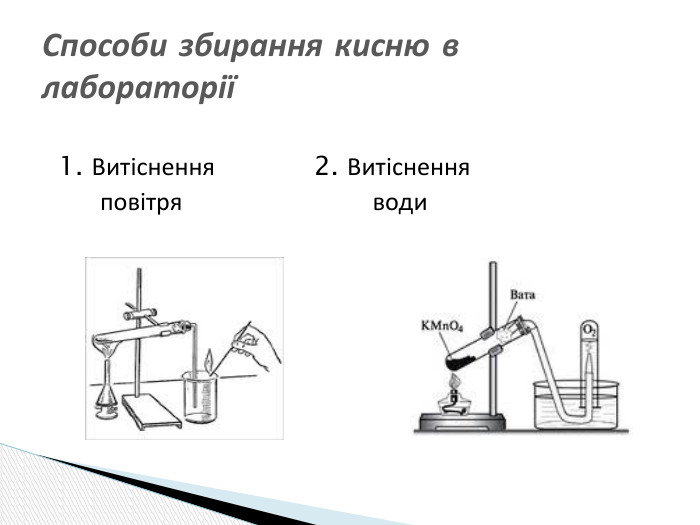
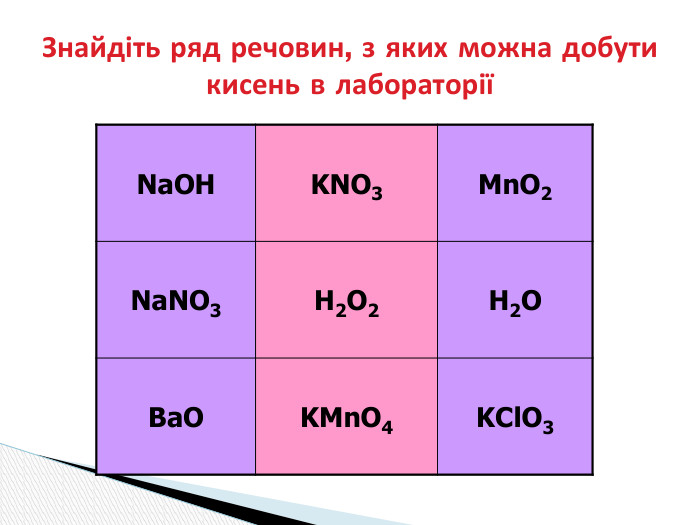
Презентація "Добування кисню в лабораторії та промисловості.Способи збирання кисню та доведення його наявності."
Про матеріал
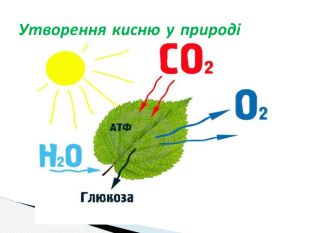
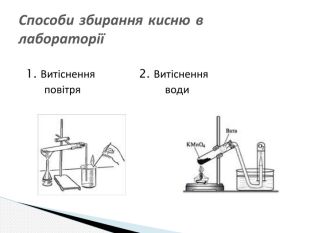
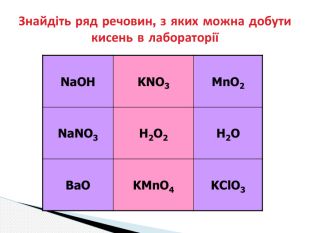
Презентація до уроку хімії 7 клас " Добування кисню в лабораторії та промисловості. Способи збирання та доведення наявності кисню" Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку