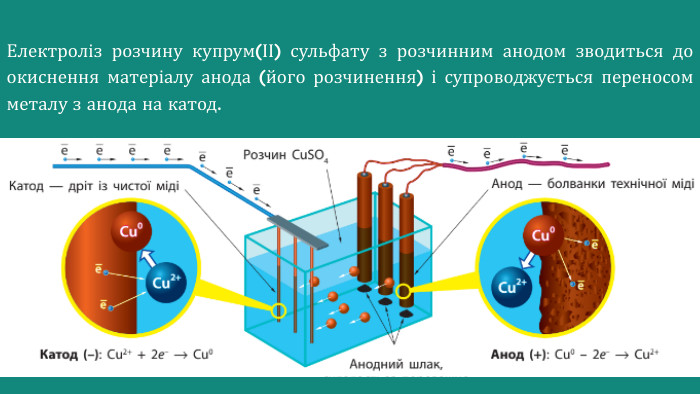
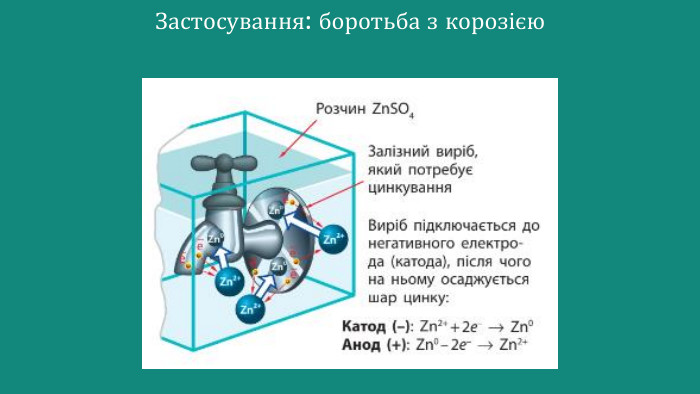
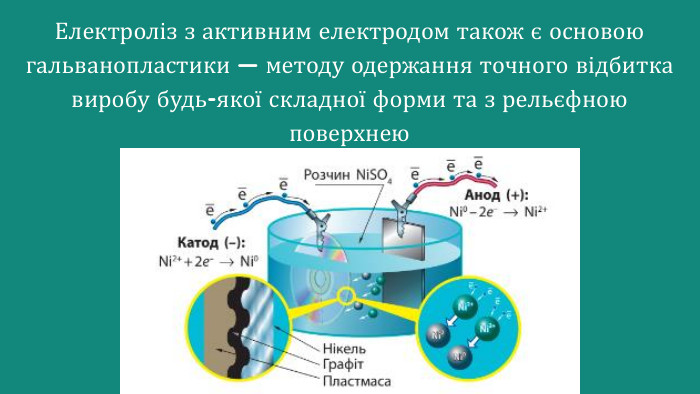
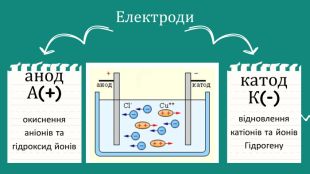
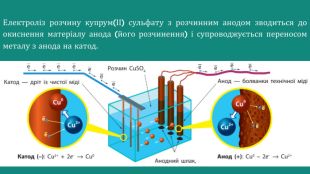
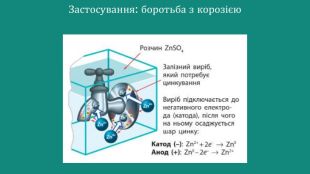
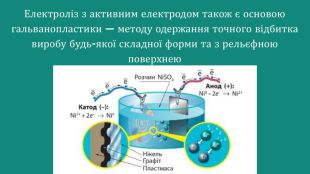
Презентація Електроліз
Про матеріал
Матеріал підійде для учнів хімічного профілю 11 класу. Презентація містить теорію та завдання для її закріплення. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку