Презентація "Гідроліз солей"












![NaОН Н2CO3 (слабкий аніон СО32-) сильна основа слабка кислота [ОН-] > [Н+] Na2CO3 Середовище визначає сильніший компонент (основа). Розчин солі має надлишок іонів ОН- - лужне середовище (рН >7) Гідроліз відбувається по слабкому компоненту: іони слабкого електроліту взаємодіють з водою, а сильні електроліти у воді розпадаються на іони: 2Na+ + CО32- + НОН ↔ Na+ + ОН- + Na+ + НCO3- Na2CO3 ↔ 2Na+ + CО32-. НОН ↔ Н+ + ОН-. В розчині натрій карбонат і вода (як слабкий електроліт, <3%) дисоціюють на іони: Протилежно заряджені іони притягуються (Na+ + ОН- + Н+ + CO32- + Na+). В результаті відбувається реакція з утворенням лугу: Na2CO3 + НОН ↔ NaОН + НCO3- + Na+ , Na2CO3 + НОН ↔ NaОН + NaНCO3, (середовище лужне) Скоротивши однакові іони в лівій і правій частині одержуємо скорочене іонне рівняння: CО32- + НОН ↔ ОН- + НCO3- , [Н+]<[ОН-] Висновок. Солі, утворені сильною основою і слабкою кислотою гідролізуються по аніону, накопичуються йони ОН-, розчин солі набуває лужну реакцію (рН >7) Під час гідролізу іони Н+ з’єднуються з карбонат-іонами в слабкий електроліт, а в розчині накопичуються іони ОН- і виникає лужне середовище (рН 7). NaОН Н2CO3 (слабкий аніон СО32-) сильна основа слабка кислота [ОН-] > [Н+] Na2CO3 Середовище визначає сильніший компонент (основа). Розчин солі має надлишок іонів ОН- - лужне середовище (рН >7) Гідроліз відбувається по слабкому компоненту: іони слабкого електроліту взаємодіють з водою, а сильні електроліти у воді розпадаються на іони: 2Na+ + CО32- + НОН ↔ Na+ + ОН- + Na+ + НCO3- Na2CO3 ↔ 2Na+ + CО32-. НОН ↔ Н+ + ОН-. В розчині натрій карбонат і вода (як слабкий електроліт, <3%) дисоціюють на іони: Протилежно заряджені іони притягуються (Na+ + ОН- + Н+ + CO32- + Na+). В результаті відбувається реакція з утворенням лугу: Na2CO3 + НОН ↔ NaОН + НCO3- + Na+ , Na2CO3 + НОН ↔ NaОН + NaНCO3, (середовище лужне) Скоротивши однакові іони в лівій і правій частині одержуємо скорочене іонне рівняння: CО32- + НОН ↔ ОН- + НCO3- , [Н+]<[ОН-] Висновок. Солі, утворені сильною основою і слабкою кислотою гідролізуються по аніону, накопичуються йони ОН-, розчин солі набуває лужну реакцію (рН >7) Під час гідролізу іони Н+ з’єднуються з карбонат-іонами в слабкий електроліт, а в розчині накопичуються іони ОН- і виникає лужне середовище (рН 7).](/uploads/files/68552/157064/169684_images/15.jpg)
![(слабкий катіон Zn2+) Zn(ОН)2 НCl слабка основа сильна кислота [ОН-] < [Н+] ZnCl2 Середовище визначає сильніший компонент (кислота). Розчин солі має надлишок іонів Н+ - кислотне середовище (рН <7) Гідроліз відбувається по слабкому компоненту: іони слабкого електроліту взаємодіють з водою, а сильні електроліти у воді розпадаються на іони: Zn2++ 2Cl- + НОН ↔ ZnОН+ + Cl- + Н++ Cl- ZnCl2 ↔ Zn2+ + 2Cl-. НОН ↔ Н+ + ОН-. В розчині цинк хлорид і вода (як слабкий електроліт, <3%) дисоціюють на іони: Протилежно заряджені іони притягуються (Zn2+ + ОН- + Н+ + Cl- + Cl-). В результаті відбувається реакція з утворенням сильної кислоти: ZnCl2 + НОН ↔ ZnОН + + Cl - + НCl ZnCl2 + НОН ↔ ZnОНCl + НCl (середовище кислотне). Скоротивши однакові іони в лівій і правій частині одержуємо скорочене іонне рівняння: Zn2++ НОН ↔ ZnОН+ + Н+, [Н+]>[ОН-] Висновок. Солі, утворені слабкою основою і сильною кислотою гідролізуються по катіону, накопичуються йони Н+, розчин солі набуває кислу реакцію (рН < 7) Під час гідролізу іони ОН- з’єднуються з іонами цинку в слабкий електроліт, а в розчині накопичуються іони Н+ і виникає кислотне середовище (рН<7). (слабкий катіон Zn2+) Zn(ОН)2 НCl слабка основа сильна кислота [ОН-] < [Н+] ZnCl2 Середовище визначає сильніший компонент (кислота). Розчин солі має надлишок іонів Н+ - кислотне середовище (рН <7) Гідроліз відбувається по слабкому компоненту: іони слабкого електроліту взаємодіють з водою, а сильні електроліти у воді розпадаються на іони: Zn2++ 2Cl- + НОН ↔ ZnОН+ + Cl- + Н++ Cl- ZnCl2 ↔ Zn2+ + 2Cl-. НОН ↔ Н+ + ОН-. В розчині цинк хлорид і вода (як слабкий електроліт, <3%) дисоціюють на іони: Протилежно заряджені іони притягуються (Zn2+ + ОН- + Н+ + Cl- + Cl-). В результаті відбувається реакція з утворенням сильної кислоти: ZnCl2 + НОН ↔ ZnОН + + Cl - + НCl ZnCl2 + НОН ↔ ZnОНCl + НCl (середовище кислотне). Скоротивши однакові іони в лівій і правій частині одержуємо скорочене іонне рівняння: Zn2++ НОН ↔ ZnОН+ + Н+, [Н+]>[ОН-] Висновок. Солі, утворені слабкою основою і сильною кислотою гідролізуються по катіону, накопичуються йони Н+, розчин солі набуває кислу реакцію (рН < 7) Під час гідролізу іони ОН- з’єднуються з іонами цинку в слабкий електроліт, а в розчині накопичуються іони Н+ і виникає кислотне середовище (рН<7).](/uploads/files/68552/157064/169684_images/16.jpg)
![(слабкий катіон NH4+) (слабкий аніон СО32-) NH4ОН Н2CO3 слабка основа слабка кислота [ОН-] ≈ [Н+] (NH4)2CO3. Середовище визначає сильніший компонент (його в складі солі немає). Розчин солі має приблизно нейтральне середовище (рН ≈ 7) Гідроліз відбувається по слабкому компоненту: іону слабкого електроліту (катіон і аніон з водою утворюють слабкі електроліти), а сильні електроліти у воді розпадаються на іони: 2NH4+ + CO32-+ НОН ↔ NH4ОН + NH4+ +НCO3- (NH4)2CO3 ↔ 2NH4+ + CO32- НОН ↔ Н+ + ОН-. В розчині цинк хлорид і вода (як слабкий електроліт, <3%) дисоціюють на іони: Протилежно заряджені іони притягуються (NH4+ +ОН-+NH4++CO32-+Н+). В результаті відбувається реакція з утворенням слабкої основи і кислої солі слабкої кислоти: (NH4)2CO3+НОН↔NH4ОН+ NH4+ +НCO3- (NH4)2CO3+НОН↔NH4ОН+NH4НCO3 (середовище приблизно нейтральне) Скоротивши однакові іони в лівій і правій частині одержуємо скорочене іонне рівняння: NH4+ + CO32-+НОН ↔ NH4ОН +НCO3- , або NH4+ + CO32-+НОН ↔ NH3 + Н2О +НCO3- , [Н+] ≈ [ОН-] - рН ≈ 7 Висновок. Солі, утворені слабкою основою і слабкою кислотою гідролізуються по катіону та аніону. Іони таких солей одночасно зв’язують іони Н+ і ОН-, утворюючи слабкі електроліти. Залежно від сили кислоти і основи середовище може бути нейтральним, слабкокислим або слабколужним (рН≈7). (слабкий катіон NH4+) (слабкий аніон СО32-) NH4ОН Н2CO3 слабка основа слабка кислота [ОН-] ≈ [Н+] (NH4)2CO3. Середовище визначає сильніший компонент (його в складі солі немає). Розчин солі має приблизно нейтральне середовище (рН ≈ 7) Гідроліз відбувається по слабкому компоненту: іону слабкого електроліту (катіон і аніон з водою утворюють слабкі електроліти), а сильні електроліти у воді розпадаються на іони: 2NH4+ + CO32-+ НОН ↔ NH4ОН + NH4+ +НCO3- (NH4)2CO3 ↔ 2NH4+ + CO32- НОН ↔ Н+ + ОН-. В розчині цинк хлорид і вода (як слабкий електроліт, <3%) дисоціюють на іони: Протилежно заряджені іони притягуються (NH4+ +ОН-+NH4++CO32-+Н+). В результаті відбувається реакція з утворенням слабкої основи і кислої солі слабкої кислоти: (NH4)2CO3+НОН↔NH4ОН+ NH4+ +НCO3- (NH4)2CO3+НОН↔NH4ОН+NH4НCO3 (середовище приблизно нейтральне) Скоротивши однакові іони в лівій і правій частині одержуємо скорочене іонне рівняння: NH4+ + CO32-+НОН ↔ NH4ОН +НCO3- , або NH4+ + CO32-+НОН ↔ NH3 + Н2О +НCO3- , [Н+] ≈ [ОН-] - рН ≈ 7 Висновок. Солі, утворені слабкою основою і слабкою кислотою гідролізуються по катіону та аніону. Іони таких солей одночасно зв’язують іони Н+ і ОН-, утворюючи слабкі електроліти. Залежно від сили кислоти і основи середовище може бути нейтральним, слабкокислим або слабколужним (рН≈7).](/uploads/files/68552/157064/169684_images/17.jpg)
![(сильний катіон К+) (сильний аніон Сl-) KОН НCl слабка основа слабка кислота [ОН-] = [Н+] KCl. Середовище визначає сильніший компонент (всі компоненти в складі солі сильні). Розчин солі має нейтральне середовище (рН = 7) Гідроліз відбувається по слабкому компоненту: іону слабкого електроліту (в даному випадку катіони та аніони з водою не утворюють слабких електролітів), а сильні електроліти у воді розпадаються на іони: К+ + Сl- + НОН ↔ К+ + ОН- + Н+ + Cl- КСl↔ K+ + Cl- НОН ↔ Н+ + ОН-. В розчині калій хлорид і вода (як слабкий електроліт, <3%) дисоціюють на іони: Протилежно заряджені іони притягуються (K+ +ОН-+Cl-+Н+). В результаті відбувається реакція з утворенням сильної основи і сильної кислоти: KCl+НОН↔KОН+HCl (середовище нейтральне) Скоротивши однакові іони в лівій і правій частині одержуємо скорочене іонне рівняння: НОН ↔ ОН- + Н+ , [Н+] = [ОН-] - рН =7 Висновок. Солі, утворені сильною основою і сильною кислотою не гідролізуються і реакцію середовища не змінюють (рН=7), тому що іони таких солей не можуть утворювати з водою слабких електролітів. (сильний катіон К+) (сильний аніон Сl-) KОН НCl слабка основа слабка кислота [ОН-] = [Н+] KCl. Середовище визначає сильніший компонент (всі компоненти в складі солі сильні). Розчин солі має нейтральне середовище (рН = 7) Гідроліз відбувається по слабкому компоненту: іону слабкого електроліту (в даному випадку катіони та аніони з водою не утворюють слабких електролітів), а сильні електроліти у воді розпадаються на іони: К+ + Сl- + НОН ↔ К+ + ОН- + Н+ + Cl- КСl↔ K+ + Cl- НОН ↔ Н+ + ОН-. В розчині калій хлорид і вода (як слабкий електроліт, <3%) дисоціюють на іони: Протилежно заряджені іони притягуються (K+ +ОН-+Cl-+Н+). В результаті відбувається реакція з утворенням сильної основи і сильної кислоти: KCl+НОН↔KОН+HCl (середовище нейтральне) Скоротивши однакові іони в лівій і правій частині одержуємо скорочене іонне рівняння: НОН ↔ ОН- + Н+ , [Н+] = [ОН-] - рН =7 Висновок. Солі, утворені сильною основою і сильною кислотою не гідролізуються і реакцію середовища не змінюють (рН=7), тому що іони таких солей не можуть утворювати з водою слабких електролітів.](/uploads/files/68552/157064/169684_images/18.jpg)



Червоний колір надає іон Н+ Синій колір надає іон ОН- НС1↔ Н+ + Cl-; Н2SO4 ↔ 2Н+ + SO42- KOH ↔ K+ + OH- NaOH ↔ Na+ + OH- НOH ↔ Н+ + OH- Речовина Колір індикаторного папірця Середовище Наявні іони рН Розчин кислоти червоний кислотне H+ рН<7 Розчин лугу синій лужне ОН- рН>7 Дистильована вода не змінюється нейтральне Н+ = ОН- рН=7 Як визначити вміст пробірок?
1 2 3 4 5 6 7 8 9 Робота з термінами. Розв’язання кросворду г і д р а т а ц і я 1. Результат взаємодії води з молекулами розчиненої речовини. 2. Речовини, які в розчинах розпадаються на іони. е л е к т р о л і т и 3. Процес розпаду електролітів на іони. д и с о ц і а ц і я 4. Гомогенна (однорідна) система змінного складу, що складається з молекул води і частинок розчиненої речовини. р о з ч и н г і д р о к с и д и 5.Електроліти, що дисоціюють на катіони металу і гідроксид-аніони (OH- ). 6. Розчинні у воді гідроксиди. л у г и і н д и к а т о р и 7. Речовини, що змінюють своє забарвлення в залежності від реакції середовища розчину. 8. Речовина, що прискорює швидкість реакції. к а т а л і з а т о р 9. Електроліти, що дисоціюють на катіони Гідрогену і аніони кислотного залишку к и с л о т и 10. Електроліти, що дисоціюють на катіони металу і аніони кислотного залишку. с о л і 11. Як називається реакція обміну між речовиною й водою? г і д р о л і з 12. Колір індикаторного папірця в кислотному середовищі? ч е р в о н и й 13. Як називається реакція взаємодії кислоти з лугом, в результаті якої утворюються сіль і вода? н е й т р а л і з а ц і ї Г і д Р о л і з с о л е й
МЕТА ЗАНЯТТЯ: Усвідомлення змісту теми дає змогу: навчитися пояснювати поняття “гідроліз солей” і суть цього процесу; характеризувати різні випадки гідролізу; вміти наводити приклади гідролізу і складати рівняння відповідних реакцій; прогнозувати реакцію середовища та експериментально її визначати.
В чотирьох пробірках розчини солей: КCl, Na2CO3, ZnCl2, (NH4)2CO3. Завдання 1 КCl Na2CO3 ZnCl2 (NH4)2CO3 Забарвлення індикаторного папірця не змінюється. Адже вода, в якій розчинені солі, має нейтральну реакцію (Н+=ОН-): НОН↔Н++ОН-, а в складі солей іонів Н+ і ОН– немає: КCl ↔ К+ + Cl- Na2CO3 ↔ 2Na+ + CО32- ZnCl2↔ Zn2+ + 2Cl- (NH4)2CO3 ↔ 2NH4+ +CO32- Отже, концентрація катіонів Гідрогену (Н+) і гідроксид-аніонів (ОН-) у розчинах не змінюється. Середовище – нейтральне. Теоретично обґрунтуйте: чи будуть діяти на індикатори розчини солей?
1. Під час роботи на робочому столі можуть знаходитися: А) сумка; Б) бутерброд; В) верхній одяг; Г) реактиви, обладнання. ІНСТРУКТАЖ З ОХОРОНИ ПРАЦІ І БЕЗПЕКИ ЖИТТЄДІЯЛЬНОСТІ при виконанні лабораторних експериментів 2. Які досліди можна виконувати? А) Будь-які. Б) Які передбачені інструкцією і не вимагають використання небезпечних для здоров’я речовин. В) Які хочеться виконати самому. 3. Яку кількість речовини необхідно використовувати, якщо в роботі не передбачено вказівок з цього приводу? А) Кілька крапель. Б) Половину пробірки (склянки). В) 1-2 мл (до ј об’єму склянки). 4. Як правильно визначити запах речовини? А) Піднести склянку до лиця на рівні носа, направити пари речовини рухом долоні. Б) Не можна нюхати речовини. В) Піднести склянку до носа і глибоко вдихнути. 5. Як правильно нагрівати ємність з речовиною? А) Прогрівати пробірку постійно по всій довжині. Б) Нагрівати тільки ту частину, де знаходиться речовина. В) Спочатку прогріти всю пробірку, потім ту частину, де знаходиться речовина. 6. Нагріваючи пробірку, необхідно: А) Направляти її отвором вгору. Б) Направляти її отвором до себе. В) Спрямовувати її у бік від усіх. 7. У разі потрапляння речовин в очі або на руки необхідно: А) Промити уражене місце великою кількістю води. Б) Протерти ганчіркою або долонею. В) Нічого не робити, продовжити виконання роботи. Г) реактиви, обладнання Б) Які передбачені інструкцією і не вимагають використання небезпечних для здоров’я речовин В) 1-2 мл (до ј об’єму склянки). А) Піднести склянку до лиця на рівні носа, направити пари речовини рухом долоні. В) Спочатку прогріти всю пробірку, потім ту частину, де знаходиться речовина. В) Спрямовувати її у бік від усіх. А) Промити уражене місце великою кількістю води.
ЗАБОРОНЯЄТЬСЯ! ► Виливати чи висипати відпрацьовані реактиви в раковину! ► Виливати чи висипати залишки реактивів у пляшки та банки, з яких їх було взято! ► Замінювати пробки та піпетки від різних банок чи пляшок! ► Набирати однією й тією ж самою ложкою чи піпеткою різні речовини! ► Залишати відкритими пляшки з рідинами та банки із сухими речовинами! ■ Приймати їжу в хімічному кабінеті, пробувати речовини на смак! ■ Брати речовини незахищеними руками! ■ залишати неубраними розсипані або розлиті реактиви
Лабораторні досліди Визначення рН середовища водних розчинів солей за допомогою індикаторів. Мета: навчитися експериментально визначати рН середовища водних розчинів солей за допомогою індикаторів. Реактиви: розчини солей калій хлориду (КCl), натрій карбонату (Na2CO3), цинк хлориду (ZnCl2), амоній карбонату ((NH4)2CO3) Обладнання і посуд: штатив з пробірками, скляні палички, універсальний індикаторний папірець. Завдання 1 В чотирьох пробірках розчини солей: КCl, Na2CO3, ZnCl2, (NH4)2CO3. Експериментально визначити реакцію середовища за допомогою універсального індикаторного папірця. Результати дослідження занести в таблицю 2. Дослід 1. У пробірку налийте 1—2 мл розчину натрій карбонату Na2CO3 і опустіть універсальний індикаторний папірець. Що спостерігаєте? Про що це свідчить? Яке значення рН розчину? Дослід 2. У пробірку налийте 1—2 мл розчину цинк хлориду ZnCl2 і опустіть універсальний індикаторний папірець. Що спостерігаєте? Про що це свідчить? Яке значення рН розчину? Дослід 3. У пробірку налийте 1—2 мл розчину амоній карбонату ((NH4)2CO3) і опустіть універсальний індикаторний папірець. Що спостерігаєте? Про що це свідчить? Яке значення рН розчину? Дослід 4. У пробірку налийте 1—2 мл розчину калій хлориду КCl і опустіть універсальний індикаторний папірець. Що спостерігаєте? Про що це свідчить? Яке значення рН розчину?
Результати дослідження реакції середовища розчинів солей КCl Na2CO3 ZnCl2 (NH4)2CO3 Висновок. В розчинах солей немає спільних для всіх солей іонів (в порівнянні з розчинами кислот і розчинами лугів). Хімічні властивості солі визначаються властивостями її катіона і аніона, які є в її водному розчині.
Проблема Чим можна пояснити різні середовища розчинів солей? Звідки беруться в розчині цинк хлориду (ZnCl2) в надлишку катіони Гідрогену H+, а в розчині натрій карбонату (Na2CO3) гідроксид-аніони OH-? Чому їх немає зовсім в розчині калій хлориду (КCl)? При цьому метал в склад солі переходить з основи, а кислотний залишок – з кислоти. Гідроліз солі – це взаємодія іонів солі з молекулами води, яка приводить до утворення слабкого електроліту та зміни реакції середовища розчину. Термін складається з двох складових частин від грецького “гідро” – вода, “лізис” – розкладання. “Гідроліз” – розкладання водою. Ме (к.з.) Меn+(ОН)n H (к.з.) Na2CO3 NaOH H2CO3 В складі солі є метал і кислотний залишок. Будь-яку сіль можна одержати в результате реакції нейтралізації (взаємодія основи і кислоти).
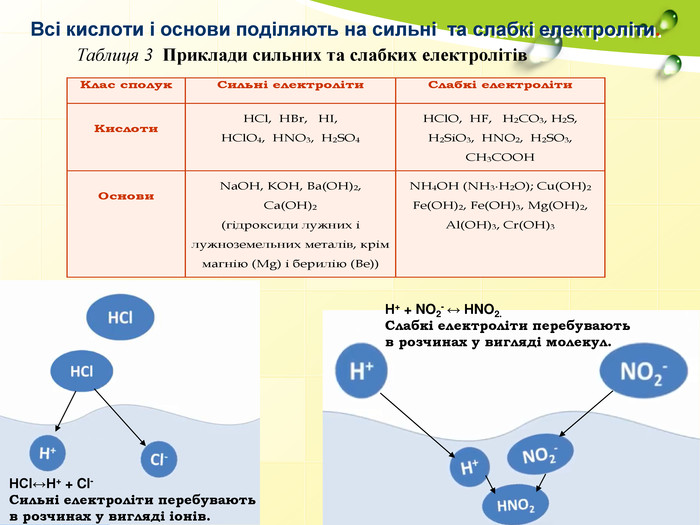
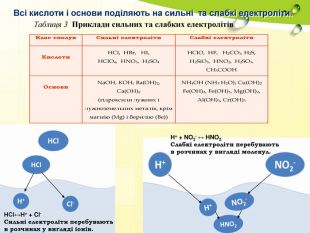
Сильні електроліти – це ті, які в розчинах переважно розпадаються на іони, а слабкі – це ті, які в розчинах об’єднуються в молекули. За здатністю до гідролізу всі солі поділяються на 4 типи: І . Солі, утворені сильною основою і слабкою кислотою. II. Солі, утворені слабкою основою і сильною кислотою. III. Солі, утворені слабкою основою і слабкою кислотою. IV. Солі, утворені сильною основою і сильною кислотою.
NaОН Н2CO3 (слабкий аніон СО32-) сильна основа слабка кислота [ОН-] > [Н+] Na2CO3 Середовище визначає сильніший компонент (основа). Розчин солі має надлишок іонів ОН- - лужне середовище (рН >7) Гідроліз відбувається по слабкому компоненту: іони слабкого електроліту взаємодіють з водою, а сильні електроліти у воді розпадаються на іони: 2Na+ + CО32- + НОН ↔ Na+ + ОН- + Na+ + НCO3- Na2CO3 ↔ 2Na+ + CО32-. НОН ↔ Н+ + ОН-. В розчині натрій карбонат і вода (як слабкий електроліт, <3%) дисоціюють на іони: Протилежно заряджені іони притягуються (Na+ + ОН- + Н+ + CO32- + Na+). В результаті відбувається реакція з утворенням лугу: Na2CO3 + НОН ↔ NaОН + НCO3- + Na+ , Na2CO3 + НОН ↔ NaОН + NaНCO3, (середовище лужне) Скоротивши однакові іони в лівій і правій частині одержуємо скорочене іонне рівняння: CО32- + НОН ↔ ОН- + НCO3- , [Н+]<[ОН-] Висновок. Солі, утворені сильною основою і слабкою кислотою гідролізуються по аніону, накопичуються йони ОН-, розчин солі набуває лужну реакцію (рН >7) Під час гідролізу іони Н+ з’єднуються з карбонат-іонами в слабкий електроліт, а в розчині накопичуються іони ОН- і виникає лужне середовище (рН 7).
(слабкий катіон Zn2+) Zn(ОН)2 НCl слабка основа сильна кислота [ОН-] < [Н+] ZnCl2 Середовище визначає сильніший компонент (кислота). Розчин солі має надлишок іонів Н+ - кислотне середовище (рН <7) Гідроліз відбувається по слабкому компоненту: іони слабкого електроліту взаємодіють з водою, а сильні електроліти у воді розпадаються на іони: Zn2++ 2Cl- + НОН ↔ ZnОН+ + Cl- + Н++ Cl- ZnCl2 ↔ Zn2+ + 2Cl-. НОН ↔ Н+ + ОН-. В розчині цинк хлорид і вода (як слабкий електроліт, <3%) дисоціюють на іони: Протилежно заряджені іони притягуються (Zn2+ + ОН- + Н+ + Cl- + Cl-). В результаті відбувається реакція з утворенням сильної кислоти: ZnCl2 + НОН ↔ ZnОН + + Cl - + НCl ZnCl2 + НОН ↔ ZnОНCl + НCl (середовище кислотне). Скоротивши однакові іони в лівій і правій частині одержуємо скорочене іонне рівняння: Zn2++ НОН ↔ ZnОН+ + Н+, [Н+]>[ОН-] Висновок. Солі, утворені слабкою основою і сильною кислотою гідролізуються по катіону, накопичуються йони Н+, розчин солі набуває кислу реакцію (рН < 7) Під час гідролізу іони ОН- з’єднуються з іонами цинку в слабкий електроліт, а в розчині накопичуються іони Н+ і виникає кислотне середовище (рН<7).
(слабкий катіон NH4+) (слабкий аніон СО32-) NH4ОН Н2CO3 слабка основа слабка кислота [ОН-] ≈ [Н+] (NH4)2CO3. Середовище визначає сильніший компонент (його в складі солі немає). Розчин солі має приблизно нейтральне середовище (рН ≈ 7) Гідроліз відбувається по слабкому компоненту: іону слабкого електроліту (катіон і аніон з водою утворюють слабкі електроліти), а сильні електроліти у воді розпадаються на іони: 2NH4+ + CO32-+ НОН ↔ NH4ОН + NH4+ +НCO3- (NH4)2CO3 ↔ 2NH4+ + CO32- НОН ↔ Н+ + ОН-. В розчині цинк хлорид і вода (як слабкий електроліт, <3%) дисоціюють на іони: Протилежно заряджені іони притягуються (NH4+ +ОН-+NH4++CO32-+Н+). В результаті відбувається реакція з утворенням слабкої основи і кислої солі слабкої кислоти: (NH4)2CO3+НОН↔NH4ОН+ NH4+ +НCO3- (NH4)2CO3+НОН↔NH4ОН+NH4НCO3 (середовище приблизно нейтральне) Скоротивши однакові іони в лівій і правій частині одержуємо скорочене іонне рівняння: NH4+ + CO32-+НОН ↔ NH4ОН +НCO3- , або NH4+ + CO32-+НОН ↔ NH3 + Н2О +НCO3- , [Н+] ≈ [ОН-] - рН ≈ 7 Висновок. Солі, утворені слабкою основою і слабкою кислотою гідролізуються по катіону та аніону. Іони таких солей одночасно зв’язують іони Н+ і ОН-, утворюючи слабкі електроліти. Залежно від сили кислоти і основи середовище може бути нейтральним, слабкокислим або слабколужним (рН≈7).
(сильний катіон К+) (сильний аніон Сl-) KОН НCl слабка основа слабка кислота [ОН-] = [Н+] KCl. Середовище визначає сильніший компонент (всі компоненти в складі солі сильні). Розчин солі має нейтральне середовище (рН = 7) Гідроліз відбувається по слабкому компоненту: іону слабкого електроліту (в даному випадку катіони та аніони з водою не утворюють слабких електролітів), а сильні електроліти у воді розпадаються на іони: К+ + Сl- + НОН ↔ К+ + ОН- + Н+ + Cl- КСl↔ K+ + Cl- НОН ↔ Н+ + ОН-. В розчині калій хлорид і вода (як слабкий електроліт, <3%) дисоціюють на іони: Протилежно заряджені іони притягуються (K+ +ОН-+Cl-+Н+). В результаті відбувається реакція з утворенням сильної основи і сильної кислоти: KCl+НОН↔KОН+HCl (середовище нейтральне) Скоротивши однакові іони в лівій і правій частині одержуємо скорочене іонне рівняння: НОН ↔ ОН- + Н+ , [Н+] = [ОН-] - рН =7 Висновок. Солі, утворені сильною основою і сильною кислотою не гідролізуються і реакцію середовища не змінюють (рН=7), тому що іони таких солей не можуть утворювати з водою слабких електролітів.
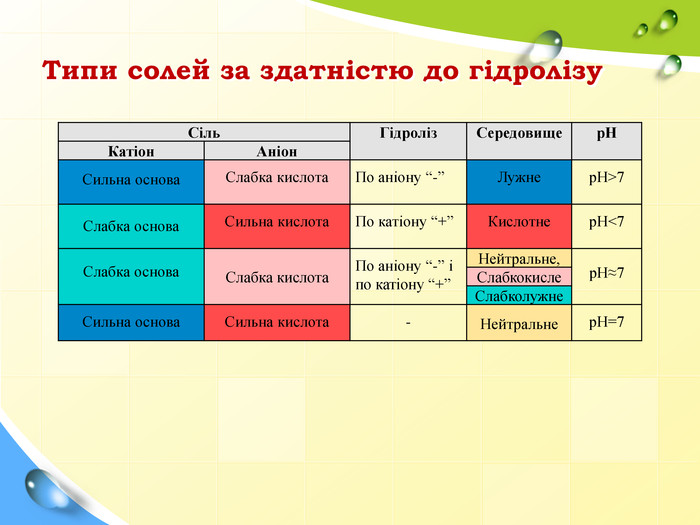
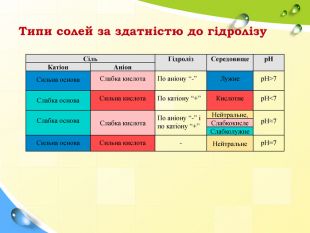
Типи солей за здатністю до гідролізу Сіль Гідроліз Середовище рН Катіон Аніон Сильна основа Слабка кислота По аніону “-” Лужне рН>7 Слабка основа Сильна кислота По катіону “+” Кислотне рН<7 Слабка основа Слабка кислота По аніону “-” і по катіону “+” Нейтральне, рН≈7 Слабкокисле Слабколужне Сильна основа Сильна кислота - Нейтральне рН=7
Побудова алгоритму до складання рівнянь реакцій гідролізу солей. За хімічною формулою солі визначаємо тип солі: якою основою і кислотою утворена сіль. 2. Визначити силу основи та кислоти. 3.Теоретично визначити середовище розчину солі. 4.Записати рівняння реакції дисоціації солі та води. 5.Записати молекулярне рівняння реакції взаємодії солі з водою, об’єднавши протилежно заряджені іони з урахуванням ступеня окиснення. 6.Записати повне іонне рівняння реакції, розклавши сильні електроліти на іони. 7.Записати коротке іонне рівняння реакції гідролізу солі, скоротивши однакові компоненти в лівій і правій частині попереднього рівняння. 8.Зробити висновки, щодо реакції середовища розчину солі.
Домашнє завдання Література: 1. Вивчити тему ”Гідроліз солей”. https://ru.calameo.com/read/005267352a1ffee5732bb Хімія: підр. для 10 кл. проф. рівня загальноосв. навч. закл. / авт. кол.: Буринська Н. М., Депутат В. М., Сударєва Г. Ф., Чайченко Н. Н.– К.: Педагогічна думка, 2010. – с. 56-59; 2. Впр. 1-6 с. 59. 3. Творче завдання: 3.1.Пригадайте, які солі входять до складу крові людини. Використовуючи знання про гідроліз, поясніть, чому середовище плазми крові слабколужне. Складіть рівняння відповідних реакцій гідролізу. 3.2. З’ясуйте з додаткових джерел, які солі знаходяться в нашій водопровідній воді та складіть рівняння їх гідролізу. 3.3. Підготувати проект на тему “Роль та практичне значення гідролізу”.


про публікацію авторської розробки
Додати розробку





















-

Фесенко Ольга Сергіївна
05.05.2023 в 05:03
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Велика Наталія Миколаївна
18.10.2022 в 21:12
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Заяць Євдокія Дмитрівна
08.02.2022 в 10:09
Прикольна презентація!!! Ви - молодчинка!!!
Дякую.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Виноградова Оксана Михайлівна
24.11.2021 в 22:48
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Власенко Оксана Миколаївна
15.11.2021 в 22:15
Дякую!
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
Показати ще 2 відгука