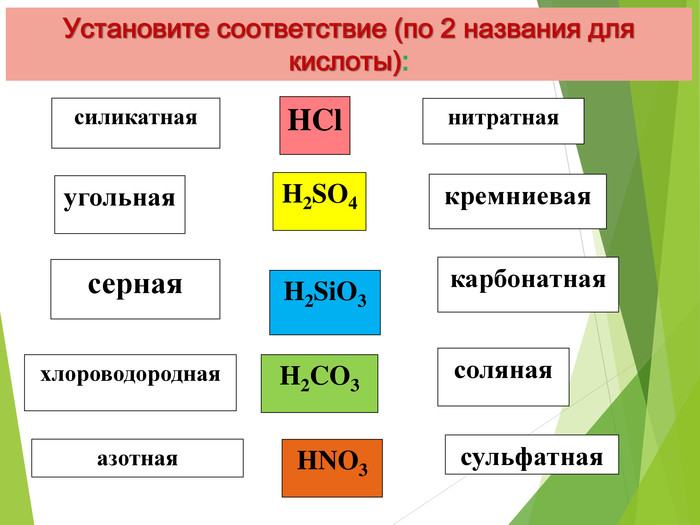
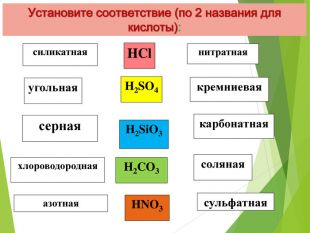
Электронная презентация к уроку на тему "Кислоты : физические свойства, применение "
Про матеріал
Презентация к уроку на тему "Кмслоты : физические свойства, применение " поможет учителю доступнее изложить новый материал ученикам.
Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку