Урок "Мило, його склад, мийна дія"
Тема: Мило, його склад, мийна дія.
Матеріал можна використовувати на уроках хімії 9 класу
Мета:
навчальна: розвивати знання учнів про карбонові кислоти та їхні солі; формувати знання про мила як солі вищих карбонових кислот; ознайомити учнів зі складом молекул мила; пояснити принцип їх мийної дії;
розвиваюча: розвивати навички виконання лабораторних дослідів, вміння складати рівняння хімічних реакцій;
виховна: виховувати бережливе ставлення до охорони довкілля, показати екологічний аспект раціонального використання мийних засобів на прикладі мила.
o Формувати групи компетентностей:
- Компетентність в природничих науках для формування в учнів практичних
навичок дослідження;
- Компетентність уміння вчитися впродовж життя шляхом спостереження
хімічних явищ і процесів та їхніх наслідків;
-Компетентність спілкування державною мовою для розуміння текстів
природничого змісту;
-Інформаційну компетентність для здійснення пошуку інформації в різних
Джерелах;
- Здоров'язбережувальну компетентність шляхом пояснення важливості
особистої гігієни та дотримання правил санітарії при використанні миючих
засобів.
Тема: Мило, його склад, мийна дія.
Мета:
- навчальна: розвивати знання учнів про карбонові кислоти та їхні солі; формувати знання про мила як солі вищих карбонових кислот; ознайомити учнів зі складом молекул мила; пояснити принцип їх мийної дії;
- розвиваюча: розвивати навички виконання лабораторних дослідів, вміння складати рівняння хімічних реакцій;
- виховна: виховувати бережливе ставлення до охорони довкілля, показати екологічний аспект раціонального використання мийних засобів на прикладі мила.
- Формувати групи компетентностей:
- Компетентність в природничих науках для формування в учнів практичних
навичок дослідження;
- Компетентність уміння вчитися впродовж життя шляхом спостереження
хімічних явищ і процесів та їхніх наслідків;
-Компетентність спілкування державною мовою для розуміння текстів
природничого змісту;
-Інформаційну компетентність для здійснення пошуку інформації в різних
Джерелах;
- Здоров’язбережувальну компетентність шляхом пояснення важливості
особистої гігієни та дотримання правил санітарії при використанні миючих
засобів.
Обладнання: д.№1:чашка з водою, сірники або голка,шматочок мила; д.№2: мідний дріт, тверде і рідке мило, спиртівка; д.№3: жир ( рослинний або тваринний), етиловий спирт, сіль кухонна, склянка, вода, піпетка, насичений розчин харчової соди, спиртівка; д.№4: дві склянки, мяка вода, жорстка ( морська) вода, розчин мила; підручники, додаткова література, Інтернет-ресурси, музичний супровід, колекція мила.
Тип уроку: Комбінований
Міжпредметні зв’язки: фізика, історія, біологія.
Форми роботи: евристична фронтальна бесіда, групова, робота в парах.
Базові поняття і терміни: жири, вищі карбонові кислоти (ВКК), гідрофобність, гідрофільність.
ХІД УРОКУ
І. Організаційний етап
• Привітання.
Доброго дня, діти,! Щиро рада вітати вас на уроці. Пропоную налаштуватися на співробітництво і взаєморозуміння
• Перевірка готовності до уроку.
Перевірте готовність до уроку. Відсутні є? Для роботи на уроці вам потрібні: підручники, зошити, додаткова література, джерела інформації, мислення і пам'ять. У вас гарний розум.
Декарт сказав : «Недостатньо просто мати гарний розум, головне – добре застосовувати його». Пам’ятайте про це під час навчання.
• Читання епіграфу на дошці:
…Найкраще засвоюються ті знання,
які поглинаються з апетитом.
Невідомий автор
Сьогодні, діти, я хочу вам побажати
Всі знання на уроці з апетитом поглинати.
А щоб знання та вміння не стали тягарем,
Побажаю вам сумління, терпіння та вдалих оцінок. Отже, почнемо.
ІІ. Актуалізація опорних знань
Перш, ніж ми приступимо до вирішення проблемних питань, давайте виконаємо невеличку самостійну роботу.
- Виконайте тест.
|
Рівень |
№ з/п |
Завдання |
Бали |
|
Початковий |
1 |
Жирами називаються органічні речовини: а)естери вищих карбонових кислот і етанолу б) естери вищих карбонових кислот і гліцерину в) естери низькомолекулярних карбонових кислот і гліцерину |
1 |
|
2 |
Жири за агрегатним станом бувають: а)тільки рідкі б) тільки тверді в) рідкі і тверді |
1 |
|
|
3 |
Тверді жири за походженням є: а) жирами рослинного походження б) тваринного походження в) немає різниці |
1 |
|
|
Середній |
4 |
Жири щодо води: а) розчинні б) погано розчинні в) гідрофобні |
1 |
|
5 |
Жири як естери вступають в реакцію: а) дегідратації б) гідрування в) гідролізу |
1 |
|
|
6 |
Жири застосовують: а) як харчовий продукт б) у медицині в) у текстильній промисловості |
1 |
|
|
Достатній |
7 |
Встановіть відповідність між формулою та назвою сполуки: а)стеаринова 1. СН3СООН б)пальмітинова 2. С17Н33СООН в)олеїнова 3. С15Н31СООН г)оцтова 4. С17Н35СООН
|
3 |
|
Високий |
8 |
Напишіть продукти реакції: С15Н31СООН + NаОН → С17Н35СООН + КОН → |
3 |
Ключ відповідей: 1- б , 2- в , 3- б , 4- в , 5-в , 6-а , 7а- 4 ,7б- 3 ,7в- 2 ,7г- 1 .
8 С15Н31СООН + NаОН = С15Н31СООNа + Н2О
С17Н35СООН + КОН = С17Н35СООК + Н2О
( проводиться взаємоперевірка за ключем відповідей)
ІІІ. Мотивація навчальної діяльності
«Наш мозок – сплячий велетень» - сказав Тоні Базам. Я хочу розбудити ваш мозок. Перед вами скринька. Завдання : відгадайте, що знаходиться в ній. При цьому проявіть кмітливість, винахідливість і здатність нестандартно мислити.
- Підказки, за якими ви можете впізнати цей предмет:
- Який хімічний продукт являє собою відносно складне з'єднання жирних кислот з лугами, а за своєю будовою відноситься до класу солей.
2. Випускається в твердому стані, рідкому, а також у вигляді порошку і гранул.
3. Лежить на полиці річ невелика, потреш її в руках, бруд умить зника.
4. Як купатися ідеш
І мене також береш.
Я гладеньке й запашне,
Ти намилюєш мене.
Всі мікроби змило
Я – корисне…
Так, це – мило, предмет нашого сьогоднішнього дослідження.
Проведемо невеличке опитування.
1. Скільки разів на день ви миєте руки милом?
а) 1 раз б) 2 рази в) більше 2 разів
2. Ви любите мити руки милом?
а) так б) ні в) іноді
3 Яким милом ви любите користуватися?
а) рідким б) твердим в) немає різниці
Отже, багато учнів люблять використовувати мило і знають його корисні властивості.
Але виникає проблемне питання: – чому мило миє, яке мило краще ?
Дослід №1:
(робота в парах)
Хід роботи: І Варіант. Візьміть чашку з водою. Помістіть туди сірник так, щоб він плавав на поверхні. Торкніться загостреним кінцем мила поверхні води збоку від сірника. Сірник рухається в бік від мила. Чому?
Хід роботи: ІІ Варіант. Покладемо залізну голку в кристалізатор з водою. Унаслідок того, що вода має поверхневий натяг, голка не тоне. Але щойно ми добавимо мила, голка потоне. Чому?
Для того щоб дати відповіді на поставленні запитання, на сьогоднішньому уроці ми розглянемо:
1.Історію мила
2.Склад мила.
3. Способи отримання мила.
4. Мило в природі.
5. Механізм миючої дії мила.
( в зошити учні записують дату, тему й план уроку)
Дослід №1:
(робота в парах)
Хід роботи: І Варіант. Візьміть чашку з водою. Помістіть туди сірник так, щоб він плавав на поверхні. Торкніться загостреним кінцем мила поверхні води збоку від сірника. Сірник рухається в бік від мила. Чому?
Хід роботи: ІІ Варіант. Покладемо залізну голку в кристалізатор з водою. Унаслідок того, що вода має поверхневий натяг, голка не тоне. Але щойно ми добавимо мила, голка потоне. Чому?
Щоб відповісти на це та інші питання, зясуємо що таке «мило» з хімічної точки зору і механізм миючої дії мила.
ІV. Вивчення нового матеріалу
1. Історія мила
(Перегляд відео «Історія мила»)
Історичні джерела вказують на те, що мило виготовлялося ще в стародавньому Шумері в Вавилоні (близько 2800 р. до н. е.). Описи технології виготовлення мила знайдені в Месопотамії на глиняних табличках, що належать приблизно до 2200 р. до н. е. Єгипетський папірус середини другого тисячоліття до нашої ери свідчить, що єгиптяни регулярно милися з використанням мила. Широко використовувались подібні мийні засоби і у Стародавньому Римі.
Легенда свідчить, що латинське слово лат. sapo (мило) походить від назви гори Сапо в древньому Римі, де відбувалися жертвоприношення богам.
Тваринний жир, що виділяється при спалюванні жертви, накопичувався і змішувався з деревною золою багаття. Отримана маса змивалася дощем в глинистий ґрунт берега річки Тібр, де жителі прали білизну і, природно, спостережливість людини не упустила того факту, що завдяки цій суміші одяг відпирався набагато легше.
Тверде мило було винайдене у 1170 році і походить від латинського sapo (суміш жиру і попелу).
Центрами виготовлення мила на Близькому Сході на VIII ст. були мануфактури міст Наблус, Фес, Дамаск, Алеппо. На основі привезеної з Сирії технології виробництва Алеппського мила на основі оливкової олії (фр. savon d'Alep ) перша французька мануфактура з виробництва аналогічного мила була згадана 1370 року біля Марселя, хоча мило виготовляли тут ще з ІХ ст. На 1430 аналогічна мануфактура була закладена в Тулоні, згодом у Ліоні, що стали визнаними центрами виробництва мила у Європі. Ще одним значним центром виробництва мила було Іспанія. На XVII ст. марсельський склад мила перебував під наглядом короля Людовика XIV, який запросив до Версалю найкращих миловарів, парфюмерів. В ході реформи короля 1688 інтендант фінансів Кольбер закріпив назву Марсельського мила (фр. savon de Marseille) за милом на основі оливкової олії та ввів основи контролю його якості. На 1709 в Марселі існувало до 30 великих мануфактур з виробництва мила. Перші цехи миловарів існували в Празі (1464), Львові (1445), де на утримання міста йшли зокрема прибутки крамів, буд, лав миловарів та двох лазень.
Створення милоподібної напіврідкої речовини «сапо» дало можливість жінкам використати її не лише для прання, але й для косметичних цілей: укладки волосся, фарбування. Проте ефект був недовготривалим, бо після потрапляння на цю суміш води, утворювалася густа піна і фарба легко змивалась. Пізніше римляни стали використовувати для варіння жири та природну соду, без золи. Таку суміш змішували і тримали на вогні до повного випаровування води, в результаті чого виходили тверді шматки мила. Але мило виявилося таке жорстке, що його використовували тільки для прання.
![]() В Європі і США безперервний процес миловаріння в промислових масштабах з'явився наприкінці 1930-х років разом з безперервним процесом гідролізу (розщеплення) жирів водою і парою під високим тиском у миловарних вежах.
В Європі і США безперервний процес миловаріння в промислових масштабах з'явився наприкінці 1930-х років разом з безперервним процесом гідролізу (розщеплення) жирів водою і парою під високим тиском у миловарних вежах.
(Коментар учня)
2. Що ж таке мило?
Ще в 1808 році французький хімік Мішель Ежен Шеврель(1786 – 1889) встановив склад мила. В результаті аналізу виявилося, що мило – це натрієва сіль вищої жирної карбонової кислоти.
А тепер ми будемо вивчати та досліджувати будову мила, а в цьому нам допоможуть знання з попереднього уроку.
До дошки викликати двох учнів, щоб написали по дві формули вищих насичених та ненасичених карбонових кислот та назватиїх.
Вищі насичені карбонові кислоти:
Пальмітинова – С15Н31СООН
Стеаринова – С17Н35СООН
Вищі ненасичені карбонові кислоти:
Олеїнова- С17Н33СООН
Лінолева - С17Н33СООН
Якщо це кислоти, то вони складаються з атомів гідрогену і кислотного залишку. Давайте підкреслимо кислотний залишок.
З точки зору хімії, мило – це сіль.
А з атомів яких елементів складаються солі?(З атомів металу та кислотного залишку).
Натрієві і Калієві солі добре розчинні у воді і їм властива миюча дія.
Складання опорної схеми:
![]()
![]() Мила
Мила
Тверді Рідкі
(Натрієві солі) (Калієві солі)
С15Н31СООNa (натрійпальміат)
С15Н31СООK(Калійпальміат)
С17Н35СООNa (натрійстеарат) С17Н33СООK (Калійолеат)
Причому, рідке і тверде мило розрізняються тільки катіонами: одним з варіантів твердого мила є С17 Н35 СООNa, рідкого – С17Н35СООК (запис у зошит).
Дослід №2
(демонстраційно)
Хід роботи:
Ми вносимо мідний дріт, змочений розчином рідкого мила, в полум'я спиртівки. В який колір воно забарвлюється?
-Фіолетовий.
Про наявність яких катіонів це свідчить?
-Катіонів калію (K+).
Ми вносимо розчин твердого мила в полум'я спиртівки. В який колір воно забарвлюється?
- Жовтий.
Про присутність яких катіонів це свідчить?
- Катіонів натрію (Na+).
Висновок: до складу твердого мила входять іони натрію, до складу рідкого – іони калію.
- ІНФОРМАЦІЙНА ХВИЛИНКА!
- Реакція забарвлення полум’я
При збудженні атомів електрони набувають більшої енергії, відбувається перехід електронів з нижчих енергетичних підрівнів на вищі.
Наступне повернення електронів на більш низькі енергетичні підрівні супроводжується випромінюванням енергії.
Атоми лужних і лужно-земельних металів легко переходять в збуджений стан. Температури полум’я звичайного пальника досить для збудження атомів, які потім повертаються в основний стан і випускають при цьому світло з довжиною хвилі видимої частини спектра.
Оскільки атоми різних хімічних елементів мають певну електронну будову, то кожен елемент випромінює світло зі своїм набором довжин хвиль (кольорів світла).
Тому при внесенні сполук лужних, лужно-земельних і деяких інших металічних елементів у полум’я воно забарвлюється в певний колір
3. Отримання мила
Отримання мила завжди було засновано на реакції омилення – гідролізу складних ефірів вищих карбонових кислот і гліцерину (тобто жирів) з лугами, в результаті якого утворюється трьохатомний спирт гліцерин і солі вищих карбонових кислот (мило). Рівняння реакції виглядає наступним чином: (запис на дошці та в зошити)
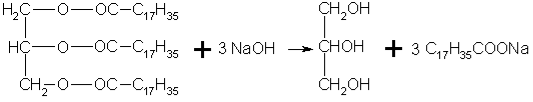
Мило готують кип'ятінням у воді жирних олій з лугами, такими, як каустична сода або каустичний поташ. Жирні олії отримують з рослинних продуктів, наприклад бавовняного, пальмової та соєвої олій, тваринних продуктів, таких, як тварина сало і риб'ячий жир, і продуктів переробки горіхів, зокрема, кокосового масла. Очищені жири піддаються гідролізу в присутності лугів. При цьому утворюється мило, жирні кислоти і гліцерин. Гліцерин відводять з реактора, а решту суміш обробляють надлишком лугу. Чисте мило з миловарного котла переливається в змішувач, де в нього вводяться ароматизатори, барвники та інші компоненти. Потім воно заливається у форми, і залишається в них на кілька діб для охолодження і затвердіння. Бічні стінки форм видаляються, маса підрівнюється, розрізається на бруски, які сушаться і піддаються штамповці на окремі шматки. Іноді мило піддають додатковій обробці для поліпшення товарного виду (наприклад, мармуруванню).
Види мила ( демонстрація колекції мила):
- туалетне мило.( Виготовляють різної форми, кольору і запаху. Туалетне мило використовують для особистої гігієни людини, миття і купання.)
- господарське мило. (Використовують для прання і очищення плям.)
- медичне мило. (Використовують з лікувальною метою. Продається в аптеках. Його потрібно використовувати за порадами лікаря.)
Дослід №3: Гідроліз жирів.
Одержання мила процес цікавий як у теоретичному, так і в практичному плані. Для прискорення дослід краще проводити не у водному, а у спиртовому середовищі.
Завдання: провести реакцію омилення жирів у лужному середовищі
Реактиви та обладнання: жир (рослинний або тваринний), етиловий спирт, сіль кухонна, склянка, вода, піпетка, насичений розчин харчової соди.
Порядок виконання: До 4-5 г жиру (вершкове масло, свинячий жир) долити 10 мл 96% етилового спирту та 5 мл насиченого розчину харчової соди. Обережно на повільному вогні нагрівайте суміш протягом 4-5 хвилин, після чого піпеткою відберіть пробу на омилення. Якщо в гарячій воді проба розчиняється, не утворюючи крапель жиру, гідроліз закінчено. Потім всю суміш необхідно вилити в склянку ємність 50 мл із насиченим розчином кухонної солі. Мило піднімається на поверхню. Зберіть мило, сформуйте брусок, або кульку, просушіть його.
Що таке мило з хімічної точки зору? (- сіль вищої жирної карбонової
кислоти.)
Чи існує мило в приподі?
4. Мило в природі
Мило можна знайти і в природі. Багато рослин мають миючу дію.
|
Мильнянка (Saponaria)
|
Смілка звичайна (Silene vulgaris) |
Остудник голий (Caryophyllaceae) |
Солодка (Glycyrrhiza glabra) |
Бузина чорна (Sambucus nigra) |
|
|
|
|
|
|
Це відбувається із-за наявності в їх складі сапонінів – аморфних речовин, які добре розчинні у воді та мають здатність давати пінні розчини. Виявляється емульсія сапоніну буквально вириває бруд з одягу та білизни: частина молекули розчиняється у воді, а частина - в жирі, утворюючи з мікрочастинками бруду сполуки, які легко вимиваються, лишаючи після себе одну чистоту. Розчини, які містять сапоніни, використовуються для миття та відбілювання особливо ніжних вовняних, шовкових та інших тканин, які псуються від звичайного мила.
Загалом, сапоніни широко поширені в природі, вони зустрічаються в листках, стеблах, коренях, квітах, плодах різних рослин. В основному це рослини, які належать до родин лілійних та амарилісових. Багаті на них і рослини родини пасльонових, ранникових, гвоздичних. Це такі рослини як мильнянка, хлопавка, горицвіт, ліщиця волотиста, які мають сапоніни в усіх своїх частинах. Особливо багато сапонінів у клітинах підземних органів. У молодих рослин їх значно менше, ніж у старих, а з моменту цвітіння їхня кількість значно збільшується.
Серед рослин-піноутворювачів у нашій місцевості на першому місці виділяють мильнянку лікарську. Її називають «мильною травою», «червоним мильним коренем», «собачим милом». Назва рослини обумовлена тим, що при розтиранні коренів мильнянки з водою утворюється пишна піна, яка тривалий час не осідає. Особливо добре миляться висушені і подрібнені кореневища, тому їх готують про запас: сушать, перемелюють в порошок, розводять водою і миються або перуть речі. Після такого прання речі набувають приємного запаху і в них не заводиться міль. Мильнянка містить 32% сапоніну. Процес можна прискорити нагріванням води: прокип'ятити кілька хвилин невелику кількість корінців. В отриманій «есенції» можна і прати, і купатися, і волосся мити - з користю для себе і без шкоди для природи. Під час миття тіла мильнянкою, не слід вдихати або пробувати піну, так як вона може викликати чхання.
При розтиранні коренів мильнянки утворюється пишна, що довго не осідає піна. Така ж піна утворюється за допомогою порошку кореня солодки. А ягоди бузини, хоч і не утворюють піни, чудово відмивають бруд.
Восени для миття рук, ніг та виведення плям на одязі використовують плоди каштана кінського, який також містить сапоніни. В шкаралупі їх 11%, у м'якоті – 6%.
Хвилинка релаксації
- Без якої речовини , на ваш погляд, важко уявити господарську діяльність мила?
-Без води.
-От і пропоную вам трохи розслабитися, закрити очі і уявити крапельки води, дзвінкі, переливаються на сонечку. (Музичний фрагмент). Час релаксації 30 сек.
5.Механізм миючої дії мила.
Перш ніж ознайомитися з мийною дією мила, хотілося б дізнатися:
- що ж таке миття? (Це очищення забрудненої поверхні рідиною, що містить мийну речовину або їх систему. Як рідину в побуті використовують воду. Добра мийна система має виконувати подвійну функцію: видалити забруднення з поверхні і перевести його у водний розчин. )
Отже, мийна речовина також повинна володіти подвійною функцією:
а) здатністю взаємодіяти з речовиною-забрудником;
б) переводити її у воду або водний розчин.
Тобто молекула мийної речовини повинна мати гідрофобну і гідрофільну частини.
Гідрофобна частина молекули мийної речовини володіє здатністю взаємодіяти з поверхнею гідрофобного забруднила (R--).
Гідрофільна частина взаємодіє з водою, проникає у воду і захоплює з собою частинку забрудника, приєднаного до гідрофобного кінця (--С=О).
Молекула мила має полярний кінець СООNа і неполярний радикал, що містить 12-18 атомів Карбону. Полярний кінець розчинений у воді, а неполярний у жирі (бруді). Подібне розчиняється у подібному. Молекули мила орієнтуються вуглеводневими радикалами до жиру, а полярними кінцями- до води. У результаті цього кожна частинка жиру оточується іонною оболонкою, що розчиняється у воді. Утворюється емульсія жиру у воді. Далі жир разом з милом видаляється змиванням.
(демонстрація)
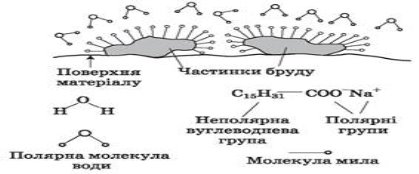
Утворена у мильному розчині піна полегшує утримання бруду, який прилипає до поверхні тоненьких мильних плівок, що оточують повітряні бульбашки.
У мила є серйозний недолік – воно втрачає свою мильну дію в жорсткій воді.
Дослід №4:
(групова робота)
Хід роботи: Візьміть дві склянки. В одну налийте м'яку воду, що не містить солей магнію і кальцію, а в іншу – жорстку. Налийте розчин мила в обидві склянки.Опишіть спостереження.Зробіть висновок.
( В одній з них (з м'якою водою) спостерігається повне розчинення, при бурхливому перемішуванні – спінювання розчину, а в склянці з жорсткою водою ми спостерігаємо випадіння пластівчастого осаду. При бурхливому перемішуванні стає помітно, що мило втратило свою мильну дію. Це пов'язано з тим, що в жорсткій воді мило утворює кальцієві і магнієві солі вищих карбонових кислот, які є нерозчинними:
2С17H35COONa + Ca2+ = (C17H35COO)2Ca + 2Na+
Якщо після прання милом, прополоскати тканину в жорсткій воді, на ній осідає нерозчинне "кальцієве мило", яке псує її вид. Тому в районах з жорсткою водою в пральнях доводиться встановлювати обладнання для пом'якшення води.
Так що ж, для прання білизни потрібно використовувати дистильовану воду?
- Не обов'язково. Зараз існують порошки з пом'якшувальним ефектом або ж для пом'якшення води можна використовувати соду.
Чи достатньо для прання брудної білизни тільки водяного розчину порошку чи необхідно ще якийсь вплив?
- Необхідно використовувати підвищену температуру і механічний вплив, так як це сприяє збільшенню швидкості руху молекул та кращому видаленню бруду.
Проблемне питання: Як зробити мило не тільки миючим, але і корисним для шкіри?
- Крім жирних кислот включати до складу мила лікувальні екстракти. Наприклад, запашне корисне мило зі свіжим медом, з олією оливи і квітками календули. Дія: зволожує шкіру, робить її гладкою і бархатистою, запах меду діє заспокійливо на нервову систему.
V. Первинне застосування одержаних знань
- Ми збагатилися потрібними знаннями і можемо дати пояснення досліду №1.
Дослід №1:
- Це відбувається тому, що поверхневий натяг води більше, ніж мильний. З різних боків на сірник діють різні сили – сірник рухається в сторону від більшої сили поверхневого натягу. Поверхневий шар дистильованої води знаходиться в натягнутому стані подібно пружній плівці. При додаванні мила і деяких інших розчинних у воді речовин поверхневий натяг води зменшується.Тому голка тоне. Мило та інші миючі речовини відносять до поверхнево-активних речовин (ПАР). Вони зменшують поверхневий натяг води, посилюючи тим самим миючі властивості води. ( ПАР руйнують поверхневий натяг).
- На основі отриманих знань, вмінь і навичок спробуємо самостійно приготувати мило.
Для цього нам необхідно:
-Жири тваринного і рослинного походження;
- Луг;
-Вода;
-Вимірювальні і нагрівальні прилади.
- Мильний калькулятор (Для збалансування жирів і лугу у рецепі)
- Пригадати правила техніки безпеки!
Хід роботи
- Складаємо рецепт мила.
- Зважуємо всі складові мила.
- Розтоплюємо жири.
- Додаємо розчин лугу до розтопленого жиру, помішуючи суміш до одержання густої маси
VІ.Узагальнення і систематизація знань
1.Виконати тест, в якому крім відповіді, потрібно вказати знання і впевненість. Якщо учень знає, він відповідає і ставить плюс, вгадує – мінус. Друга графа – упевнений «+», не впевнений – «-».
|
Тестове завдання |
Знаю / не знаю |
Упевнений/ не впевнений |
|
1.За хімічною природою мило – це
А) натрієві солі ВКК; Б) ВКК; |
|
|
|
2.Яке середовище має розчин господарського мила? |
|
|
|
3.Яка вода краще всього підходить для використання з милом? |
|
|
|
4.Гідрофільні властивості буде мати: |
|
|
|
5.Рослинна олія по відношенню до води: |
|
|
|
6.Чим зумовлені миючі властивості мила? |
|
|
VІІ. Домашнє завдання
І рівень.§ ____.Прочитати.Усно відповісти на питання в кінці параграфа.
ІІ рівень.Підготувати презентацію «Мило, його склад, мийна дія».
ІІІ рівень. Домашній дослід № 1.
Тема роботи - Мило ручної роботи.
Інгредієнти: Дитяче мило – 100 г Мед – 2 чайні ложки. Молоко – 2/3 склянки.
Гліцерин – 1 чайна ложка. Обліпихова олія – 1 столова ложка.Квітки ромашки – для зовнішнього вигляду.Ароматичне масло – не більше 15 крапель. Ви можете вибрати масло на свій смак, можна будь-яке цитрусове, тоді колір мила в результаті вийде жовтим. А можна вибрати ефірне масло з ароматом трави чи квітів, головне не переборщити, інакше можна зіпсувати мило. Якщо сумніваєтеся, то можете взагалі не додавати ефірне масло, в цьому випадку вийде природний запах мила.
Хід роботи.
1. Натріть на тертці шматок "Дитячого" мила.
2. Додайте до нього гарячої води. В якості рідини можна брати не тільки воду, але і молоко, вершки, соки, трав'яні настої, чай, каву.
3. Поставте каструлю з розмоченої мильною стружкою на водяну баню і нагрівайте, періодично помішуючи (щоб не було грудок). Мильна маса не повинна кипіти.
4. Коли маса стане однорідною, зніміть каструльку з вогню, швидко додайте підготовлені добавки (наприклад, мелену каву або морську сіль), масло-основу (персикове, абрикосове, виноградних кісточок, авокадо, обліпихове, оливкове, жожоба, рицинове – на ваш вибір). Можна додати ефірні олії, мелені трави, мед.
5. Мильну масу з добавками швидко розкладіть у форми і поставте в холодильник застигати. Як тільки брусочки охолонуть, вийміть їх з форми і розкладіть на досушування на пару днів.
ІV рівень. Підготувати повідомлення на одну з тем:
1. Перспективи застосування мила.
2. Як моя родина використовує мило.
3. Миловарна промисловість України
VІІІ. Підбиття підсумків уроку
Підведемо підсумок нашої роботи. Ми ставили перед собою проблемне питання «Чому мило миє?» Які варіанти відповідей на нього ви зараз можете запропонувати? Як правильно обрати для себе мило?
• За рахунок гідролізу молекул з утворенням лужного середовища.
• За рахунок зменшення поверхневого натягу води молекулами мила.
• За рахунок здатності молекул мила обволікати частинки бруду і переміщати їх з поверхні субстрату.
І ще декілька проблемних питань.
• Чому у всі лосьйони для очищення шкіри обличчя, крім речовин, що розчиняють шкірне сало і видаляють забруднення, обов'язково додають слабкі кислоти?
- При гідролізі мила утворюється лужний розчин,що несприятливо впливає на шкіру. Для його нейтралізації використовують слабкі кислоти.
• Де витрачається більше мила: в м'якій чи жорсткій воді?
- Більше мила витрачається в жорсткій воді, так як при взаємодії з іонами кальцію утворюються нерозчинні солі.
• Чому людям з підвищеною жирністю шкіри обличчя та голови лікарі-дерматологи рекомендують вмиватися і мити голову рідким милом або «зеленим милом»?
- Калієві солі вищих карбонових кислот порівняно з натрієвими краще розчиняються у воді і тому володіють сильнішою миючою дією.
• Чому мило погано милиться у морській воді?
- Морська вода у великій кількості містить іони магнію і кальцію, які утворюють нерозчинні солі карбонових кислот.
- Рефлексія
Сьогодні на уроці я навчився…..
Сьогодні я зрозумів, що …..
Мені сподобалось, що …..
Для мене стало новим ...
Мені було легко….
В мене викликало труднощі….
- Оцінювання навчальних досягнень учнів
|
№ з/п |
Прізвище, ім’я |
Тест |
Дослід №1 |
Дослід №2 |
Дослід №4 |
Узагальнення |
Підсумкова оцінка |
|
|
|
|
|
|
|
||
|
1 |
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
1


про публікацію авторської розробки
Додати розробку





