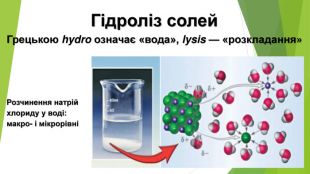
Презентація по темі: "Гідроліз солей"




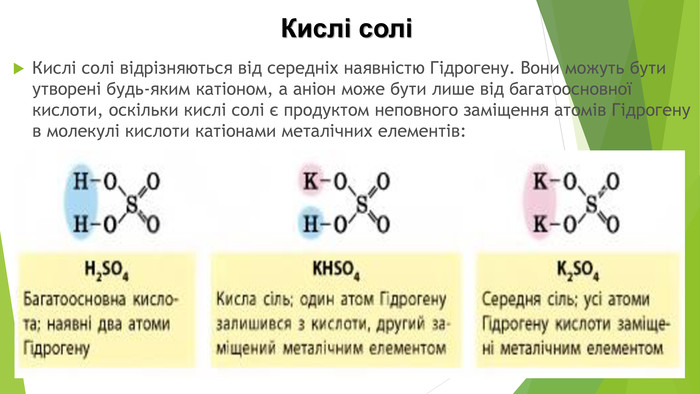












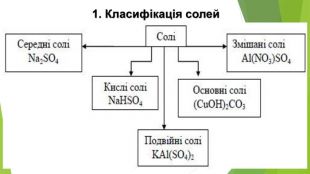
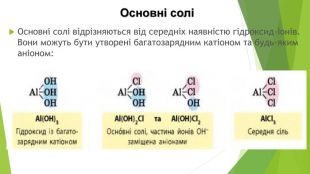
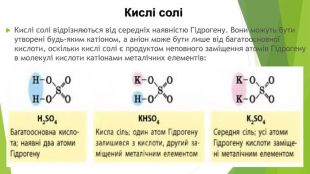
Кислі солі Кислі солі відрізняються від середніх наявністю Гідрогену. Вони можуть бути утворені будь-яким катіоном, а аніон може бути лише від багатоосновної кислоти, оскільки кислі солі є продуктом неповного заміщення атомів Гідрогену в молекулі кислоти катіонами металічних елементів:
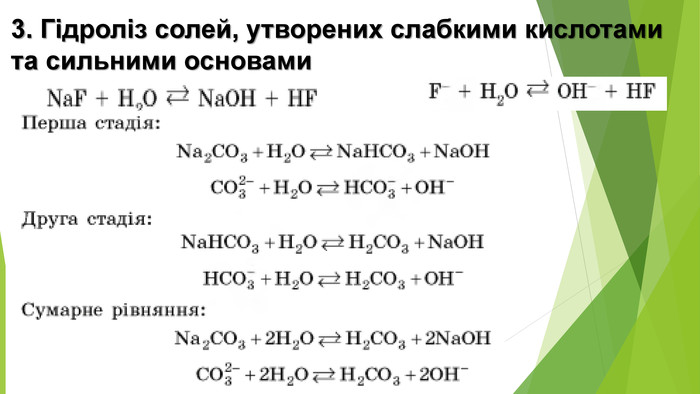
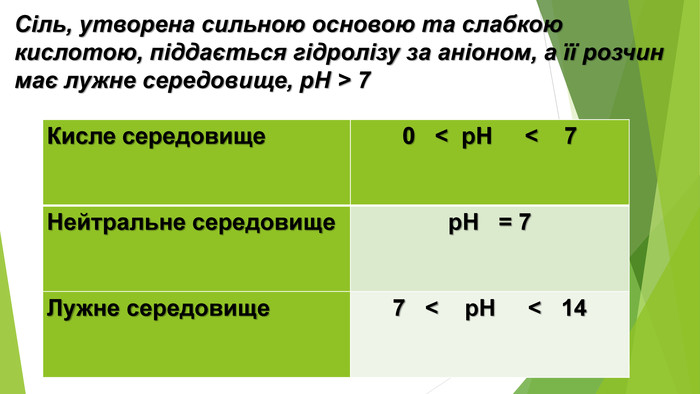
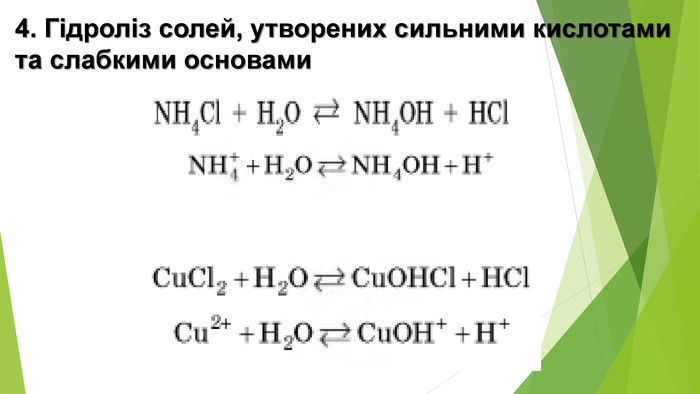
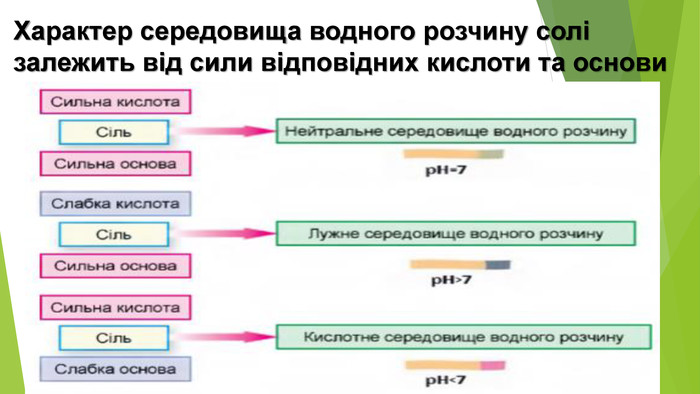
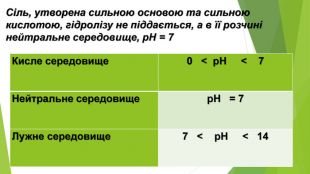
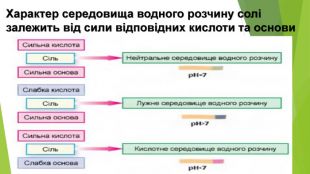
Сіль, утворена слабкою основою та слабкою кислотою, піддається гідролізу як за катіоном, так і за аніоном. Кислотність розчину визначається тим, який з утворених електролітів сильніший. Якщо сильнішою є кислота, то середовище кислотне, а якщо сильнішою є основа — лужне{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}Кисле середовище 0 < р. Н < 7 Нейтральне середовище р. Н = 7 Лужне середовище 7 < р. Н < 14
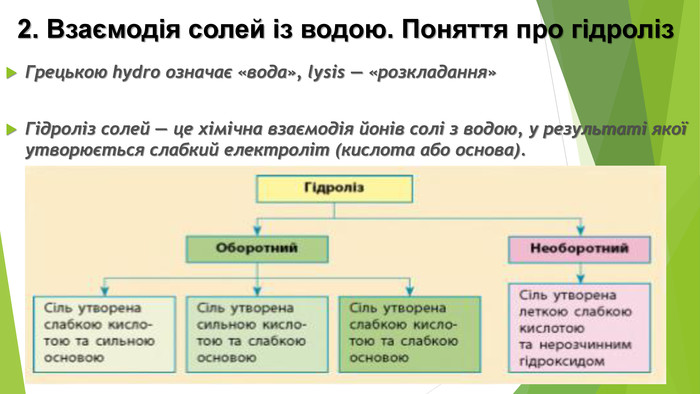
6. Сіль, утворена сильною кислотою та сильною основою. Але обидва продукти реакції є сильними електролітами і у вигляді молекул у розчині існувати не можуть. Отже, така реакція не відбувається. У цьому можна переконатися, якщо скласти рівняння гідролізу в йонній формі: усі йони в цьому рівнянні скоротяться. Отже, солі, утворені сильною кислотою і сильною основою, гідролізу не піддаються, у їхніх розчинах середовище нейтральне
ЛАБОРАТОРНИЙ ДОСЛІД № 1 Визначення p. H середовища водних розчинів солей за допомогою індикаторів. Обладнання: штатив із пробірками, піпетки, пінцети Реактиви: універсальний індикатор (розчин або папір), розчини солей: натрій етаноату, натрій карбонату, амоній хлориду, цинк хлориду, амоній етаноату, натрій хлориду. Правила безпеки: • для виконання дослідів використовуйте реактиви в невеликих кількостях; • остерігайтеся потрапляння реактивів на шкіру, в очі, на одяг; • у разі потрапляння їдкої речовини змийте її великою кількістю води та протріть ушкоджене місце розведеним розчином боратної кислоти. У пробірки налийте по 1-2 мл наявних розчинів солей. До кожної пробірки додайте індикатор і визначте p. H розчинів, використовуючи еталонну шкалу. Установіть, у яких випадках відбувається гідроліз солі, запишіть рівняння в молекулярній та йонно-молекулярній формах
1. Польові шпати, зокрема ортоклаз (KAl. Si3 O8), - найпоширеніші породотвірні мінерали, масова частка яких у земній корі близько 50%. Унаслідок гідролізу та інших процесів утворюються осадові породи. 2. Каолінові шари над гранітами в Полонському родовищі каолінів (Україна, Хмельниччина)
Якщо вирощувати гортензію на ділянці, де рівень p. H ґрунту становить 6,0-6,2, то на рослині розцвітуть рожеві квіти. Якщо ж знизити p. H до 5,0-5,2, то виростуть квіти з блакитними або фіолетовими пелюстками. Ґрунт з p. H між 5,5-6,0 зумовить фіолетовий колір квітів або суміш рожевого і блакитного на одному кущі гортензії. Якщо полити нейтральний ґрунт слабким розчином ферум(ІІ) сульфату, гортензія забарвиться у фіолетовий колір
Із переліку речовин випишіть ті, що піддаються гідролізу. Складіть для них рівняння реакцій гідролізу та визначте кислотність їхніх розчинів. Якщо для солі характерний ступінчастий гідроліз, складіть рівняння гідролізу тільки за першою стадією. Na2 S04, K2 S03, Cu. S04, KBr, AICI3, Na. N02, Mn. Br2, K3 P04, Ba. CI2, Cr(N03)3, Rb. CI, Na2 Si03, KN03, Mg. CI2, CH3 COONa, Fe. CI2, Na. HC03, K2 HP04


про публікацію авторської розробки
Додати розробку

















-

Грищенко Ирина
24.11.2025 в 21:33
дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Потапова Галина Іванівна
01.11.2025 в 11:17
дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Краснокутська Оксана Віталіївна
10.11.2024 в 19:45
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Присяжна Олена Володимирівна
23.01.2024 в 15:43
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Ящук Юлія Леонідівна
25.11.2022 в 17:18
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Остаповець Юрій
02.11.2022 в 21:05
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Товстолес Лариса
20.10.2022 в 21:42
дякую.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Велика Наталія Миколаївна
18.10.2022 в 21:14
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Підкалюк Любов Петрівна
16.10.2022 в 22:38
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Авєркіна Світлана Анатоліївна
10.10.2022 в 18:38
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Авєркіна Світлана Анатоліївна
10.10.2022 в 18:38
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Спільніченко Ольга Іванівна
14.03.2022 в 21:31
Загальна:
4.3
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
4.0
-

Вербицька Зоя Володимирівна
12.11.2021 в 07:54
Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Теребіленко Людмила Володимирівна
09.11.2021 в 10:00
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Суворова Тетяна Миколаївна
19.10.2021 в 11:37
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Сердюк Ольга
12.10.2021 в 05:42
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Шевченко Світлана Василівна
01.04.2021 в 09:14
дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Слобідчук М С
30.03.2021 в 06:54
дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Гончарова Тетяна Олександрівна
09.02.2021 в 09:05
Велике дякую за розробку! Все виважено, структуровано, відповідає темі.
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Рябченко Віталік
25.11.2020 в 23:19
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Рашко Света
12.11.2020 в 21:59
Дякую.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Ростя Анна Володимирівна
09.05.2020 в 16:25
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Стародуб Інна Анатоліївна
19.03.2020 в 20:45
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Каленчук Еліна Валентинівна
17.11.2019 в 21:15
Дуже вдала презентація, що охоплює всю тему. Буду із задоволенням користуватися!
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
Показати ще 21 відгук