Презентація на тему" Ковалентний зв'язок. Його утворення."
Про матеріал
Презентація містить інформацію, яку можна використовувати при розгляді теми: "Ковалентнтй зв'язок. Його утворення" Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку









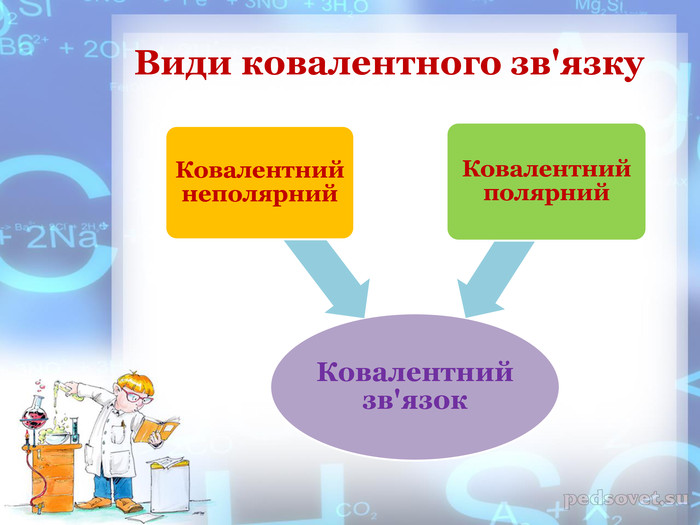


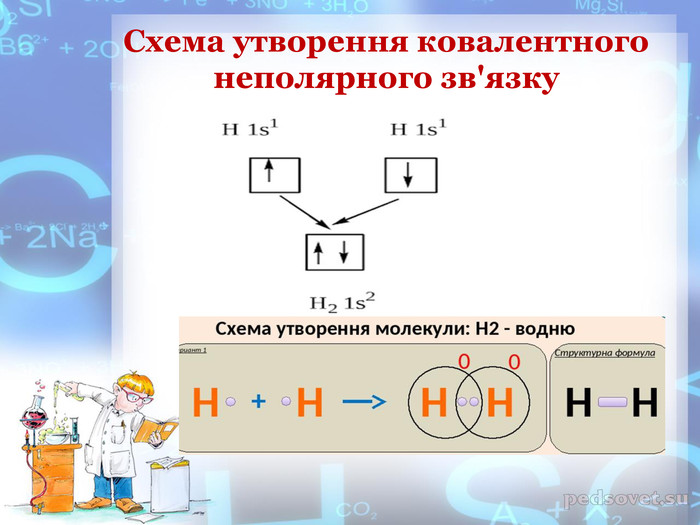
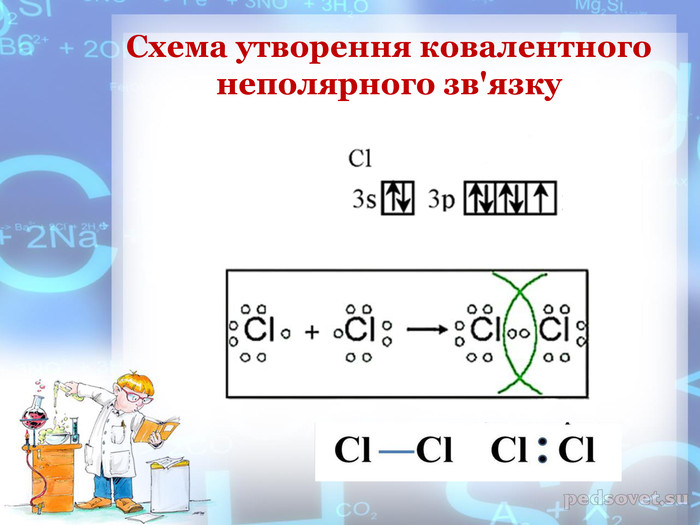

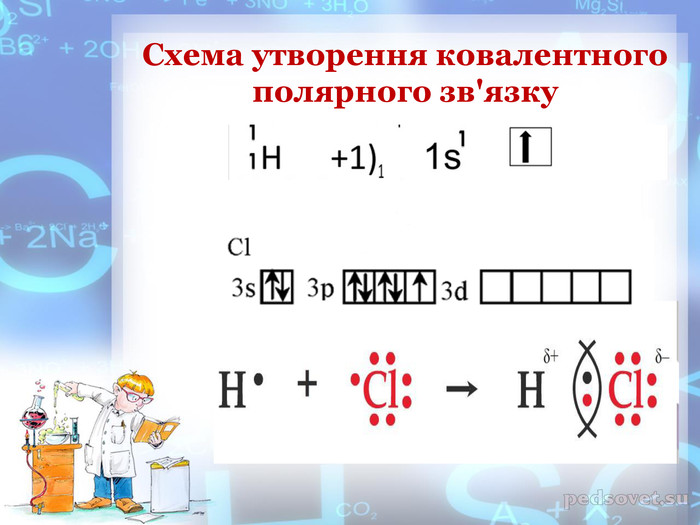




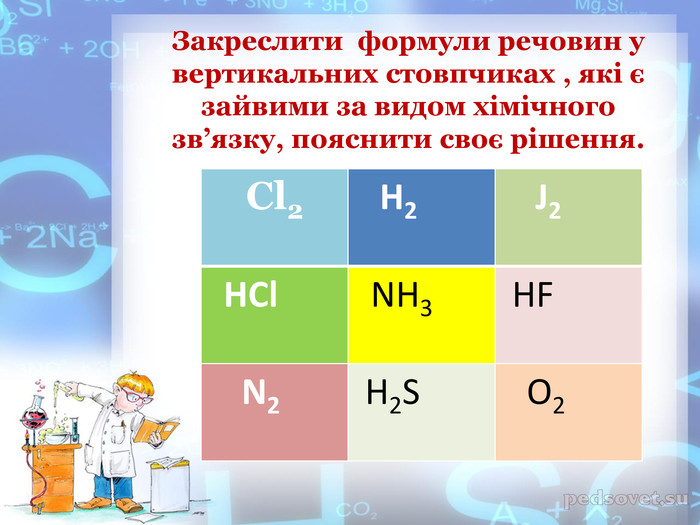


















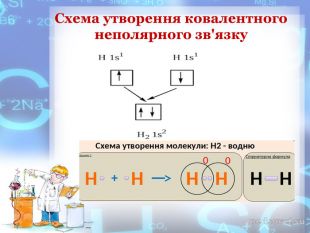
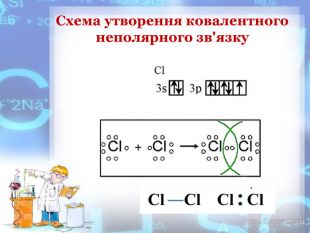

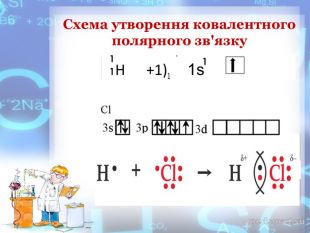




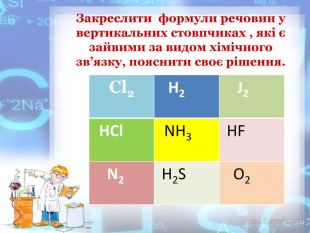







-

Задорожна Лідія Яківна
12.11.2024 в 13:40
Дякую!!!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Абарбарчук Вікторія Василівна
21.12.2023 в 09:13
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Дюкова Олена Юріївна
16.11.2023 в 15:42
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Овсієнко Надія Володимирівна
16.11.2023 в 05:13
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Воронівська Наталья Гуріївна
19.11.2022 в 20:33
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 2 відгука