Презентація на тему "РОЗВ’ЯЗУВАННЯ РОЗРАХУНКОВИХ ХІМІЧНИХ ЗАДАЧ"
















ПЕРЕДМОВА Розв'язування розрахункових задач у шкільному курсі хімії є складовою частиною процесу навчання хімії. Це один із кращих раціональних методів засвоєння і закріплення теоретичного матеріалу, формування в учнів вмінь використовувати одержані знання на практиці. У процесі розв'язування задач учні розвивають уміння логічного мислення, аналізу і синтезу, індукції та дедукції; виховують у собі самостійність і прагнення до подолання труднощів; розширюють свій кругозір. Щоб успішно використовувати розв'язування задач як специфічний метод навчання хімії, необхідно орієнтуватися в типах задач, передбачених у різних варіантах програм з хімії; у методичних підходах до їх пояснення; в організації діяльності учнів в процесі їх розв'язування. Метою запропонованих рекомендацій є надання допомоги молодим учителям хімії у навчанні учнів розв'язуванню хімічних задач.
Типи розрахункових задач в шкільному курсі хіміїОбчислення відносної молекулярної маси за формулами речовин. Обчислення масової частки елемента в сполуці за формулою речовини. Обчислення маси певної кількості речовини, кількості речовини за відомою масою. Розрахунки за хімічними рівняннями маси, об'єму або кількості речовини за відомою порцією однієї із вихідних речовин або продуктів реакції. Розрахунки за термохімічними рівняннями реакцій. Обчислення маси певного об'єму газу за нормальних умов або його кількості речовини. Обчислення відносної густини газів, чи відносної молекулярної маси за відносною густиною. Розрахунки коефіцієнту розчинності і маси речовини в певній порції насиченого розчину. Розрахунки масової частки і маси речовини в розчині (об'ємної, молярної частки). Розрахунки за формулою молярної концентрації. Розрахунки об'ємних відношень газів за хімічними рівняннями. Розрахунки за рівняннями реакцій, у яких одна з речовин взяті в надлишку. Визначення масової чи об’ємної частки виходу продукту від теоретично можливого. Обчислення порції продукту реакції за відомою порцією вихідної речовини, що міститьдомішки. Знаходження молекулярної формули речовини за даними масовими частками елементів, їх масами чи масами продуктів, що утворені з неї.
Зміст і визначення основних понять, що використовуються при розв’язуванні задач в шкільному курсі хімії. Кількість речовини системи - фізична величина, що характеризується кількістю структурних частинок всистемі (атомів, молекул, іонів, електронів та ін. і. Позначається кількість речовини V (ню) або п і може визначатисяза формулою: V= N/ Nа де N - кількість частинок в системі, NА - стала Авогадро. У Міжнародній системі одиниць (СІ) за одиницю кількості речовини прийнято моль. Моль - це кількість речовини, що містить стільки структурних одиниць (молекул, атомів, іонів, електронів чи інших), скільки атомів міститься в 0,012 кг ізотопу вуглецю С - 12. Молярна маса (М) - величина, що дорівнює відношенню маси речовини (m) до кількості речовини (v): М = m/v (кг/моль, г/моль).
Молярний об'єм (Vm) - величина, що дорівнює відношенню об'єму речовини (V) до кількості речовини (v) : V m= V/v (м /моль, л/моль). Відносна атомна маса елемента (Аг) - величина,що дорівнює відношенню середньої маси атома природного ізотопічного складу елемента (mа) до атомної одиниці маси (скорочено а.о.м.). Атомна одиниця маси являє собою 1/12 частину маси атома ізотопу вуглецю С - 12. 1 а.о.м. = 1,674*10-27кг. Аг = mат/ а.о.м.
Відносна молекулярна маса (Мг) - величина, що дорівнює відношенню середньої маси молекули природногоізотопічного складу речовини (m. М) до атомної одиниці маси : Мr = m(мол.)/а.о.м. Молярна концентрація розчину (С) - величина, що дорівнює відношенню кількості розчиненої речовини (n) дооб'єму розчину (V): С = n / V (моль/м3, моль/л).
Розчинність, або коефіцієнт розчинності - величина, що показує масу розчиненої речовини в 100 г розчинника в насиченому розчині при даній температурі. Швидкість хімічноі реакціі (V) - величина, що показує зміну молярної концентрації однієї з реагуючих речовин (С2 – С1) за одиницю часу: V= (С2-С1)/(t2-t1), (моль/л*с).
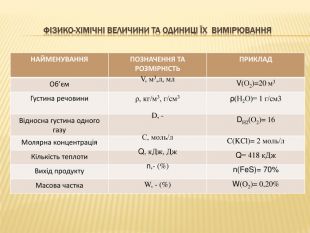
ФІ3 ИКО-ХІМІЧНІ ВЕЛИЧИНИ ТА ОДИНИЦІ ЇХ ВИМІРЮВАННЯ{00 A15 C55-8517-42 AA-B614-E9 B94910 E393}НАЙМЕНУВАННЯПОЗНАЧЕННЯ ТА РОЗМІРНІСТЬПРИКЛАДМаса атома mа, а.о.м. mа(О) = 16 а.о.м. Маса молекулиm. М, а.о.мm. М(О2) = 32 а.о.м. Відносна атомна маса. Аг,-Аr(О)= 16 Відносна молек-на маса. Мг, -Мr(О2) = 32 Кількість речовини. М, г моль, кг/моль n, моль М(О2) = 32 г/моль. N(Н2)= 2 моль. Маса речовиниm, кг, г, мг, т M(Ca. O)= 40 г. Молярний об’єм Vm, л/моль, м3/моль V, м3,л, мл. Vm(CO2)=22,4л/моль
ФІ3 ИКО-ХІМІЧНІ ВЕЛИЧИНИ ТА ОДИНИЦІ ЇХ ВИМІРЮВАННЯ{00 A15 C55-8517-42 AA-B614-E9 B94910 E393}НАЙМЕНУВАННЯПОЗНАЧЕННЯ ТА РОЗМІРНІСТЬПРИКЛАДОб’єм. V, м3,л, мл. V(О2)=20 м3 Густина речовиниρ, кг/м3, г/см3ρ(Н2 О)= 1 г/см3 Відносна густина одного газу. D, -DН2(О2)= 16 Молярна концентрація. С, моль/л C(KCl)= 2 моль/л. Кількість теплоти. Q, к. Дж, Дж Q= 418 к. Дж. Вихід продуктуn,- (%)n(Fe. S)= 70%Масова частка. W, - (%) W(O2)= 0,20%
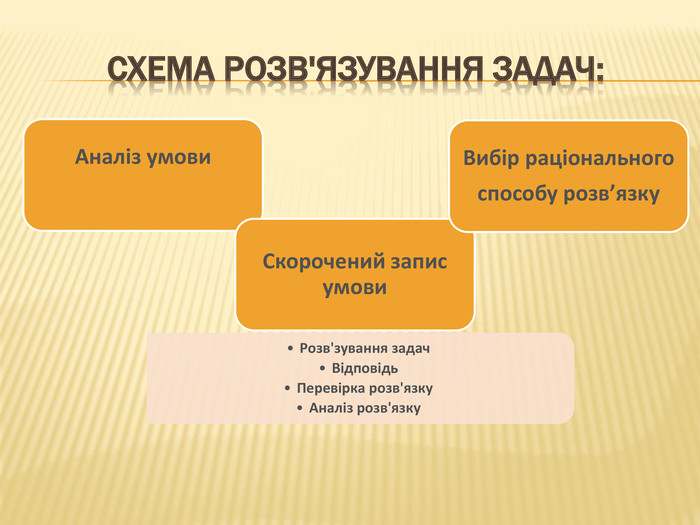
При розв’язку конкретної задачі треба дотримуватися таки правил: Прочитати умову задачі і запропонувати учням записати її в зошит. Проаналізувати задачу, користуючись скороченою умовою, записаної за допомогою прийнятої символіки. Встановити логічні зв'язки між даними величинами і шуканою. Розглянути і проаналізувати хімічні процеси, що лежать в умові задачі. Скласти план розв'язку, осмисливши логічну послідовність дій. Розглянути хід розв'язку задачі по діях із записами питань даних, виконати розрахунки в тих одиницях вимірювання, що задані умовою задачі, або загальноприйняті. Сформулювати відповідь, порівнявши її з умовою задачі. Перевірити правильність розв'язку задачі шляхом розв’язку її іншим способом або розв’язуванням зворотної задачі. Наприкінці проаналізувати основні етапи розв’язку задач даного типу.ppt_xxshearppt_x
Способи розв'язку деяких типів розрахункових задач Учні використовують такі формули і перетворення з ними: 1. n = N / NА, звідси N = Nа * n, NА = N / n;2. M = m / n, звідси m = М * n, n = m / М;3. Vm = V / n, звідси V = Vm * n, n = V / Vm;4. P = m / V, звідси m = V * р, V = m / р;5. DН2 = Mr / Mr(Н2), звідси Мr = DН2* Мг(Н2) 6. n = m реч. / m р-ну, звідси m реч. = n * m р-ну., m р-ну. = m реч. / n; 7. С = n реч. / n р-ну звідси n реч. = С * n р-ну., n р-ну. = n реч. / С;
приклади. Задача . Який об'єм займе при н.у. кисень масою 8 г.?Дано: m(О2) = 8 г. V(О2) - ?Підбираємо формулу для обчислення об'ємів: V = Vm * n (1), в ній невідома кількість речовини n. Підбираємо формулу для визначення n: n = m / М (2). Підставляємо в вираз (1) n : V = Vm* m / М. Підставляємо в одержану формулу числові значення величин: V(О2) = 22,4 л/моль * 8 г / 32 г/моль = 5,6 л. Відповідь: кисень масою 8 г. при н.у. займає об'єм 5,6 л.
Задача. Яку масу нітратної кислоти можна одержати з азоту об'ємом 224 м3 (н.у.) ?Дано: V(N2) = 224м3m(N2) - ? 1. Складаємо стехіометричну схему утворення НNО3; N2 → NН3 → NО →NО2 → HNO3, або N2 →2 HNO3. 2. За схемою, як і за рівнянням, проводимо обчислення: 224м3 х кг N2 → 2 HNO3 22,4м3 2*63 кг х = 224м3 * 2 * 63 кг = 1260 кг. 22,4м3 Відповідь: з азоту об'ємом 224 м3 можна одержати 1260 кг нітратної кислоти
Список використаної літератури. Буринська Н. М. Тренувальні вправи з органічної хімії,- К.: Рад. школа,1981. Барко В.І. Задачі виробничого змісту у викладанні хімії. - К.: Рад. школа,1989. Гольдфарб Я. Л., Ходаков Ю. В., Додонсз Ю. Б. Сборник задач и упражнений по химии: Учебное пособие для учащихся 8-11 кл. сред. шк. - М.: Просвешение, 1992. Глорнозов П. А., Рысс В. Л. Проверочные работы по химии. -М. - Просвещение, 1986. Ерыгин І. П., Шишкин Е. А. Методика решения задач по химии.- М.: Просвещение, 1982. Ласий Ю. М. Решение задач по химии с помощью уравнений и неравенств.- М.: Просвещение, 1987. Польские химические олимпиады: Сборник задач/ Пер с польск.-М.: Мир,1980. Програми з хімії, фізики, біологіі, географії для шкіл України.500 задач по химии.- М. Просвещение, 1981. Середа І. П. Конкурсні задачі з хімії,- К/. Вища школа, 1996. Стоцкий Л. Р. Физические величиньы и их единицы: Справочник.- М.: Просвещение,1984. Хомченко Г. П., Хомченко У. Г. Задачи по химии для поступающих в вузы.- М.: Высшая школа, 1986 и след. Хімія: завдання та тести. Посібник-довідник для вступників до вишіх навчальних закладів. К:-Генеза, 1993. Чуранов С. С. Химические олимпиады в школе.- М.: Просвешение, 1982. Шаповалов А.І. Методика розв'язування задач з хімії.-К.: Рад.школа, 1989.


про публікацію авторської розробки
Додати розробку