Презентація на тему "Сульфатна кислота"
Про матеріал
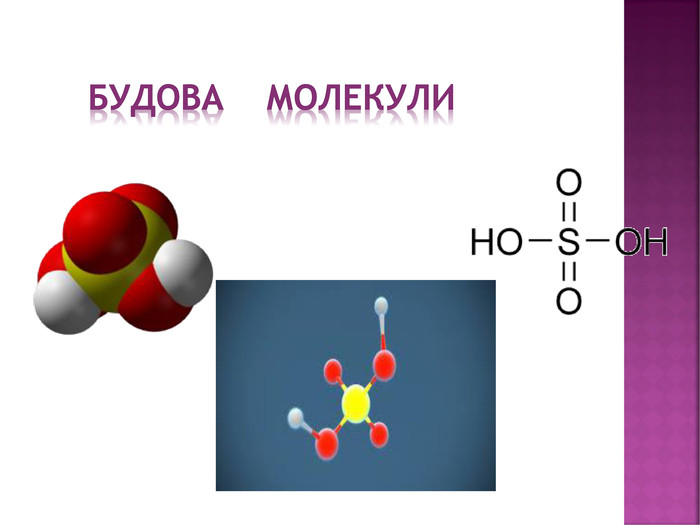
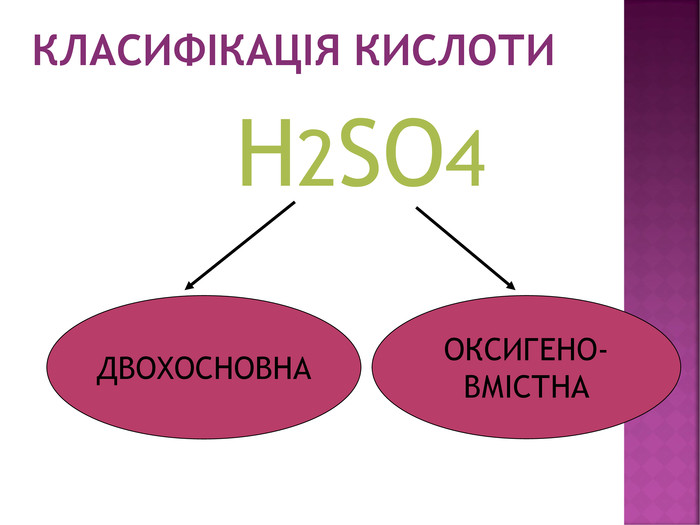
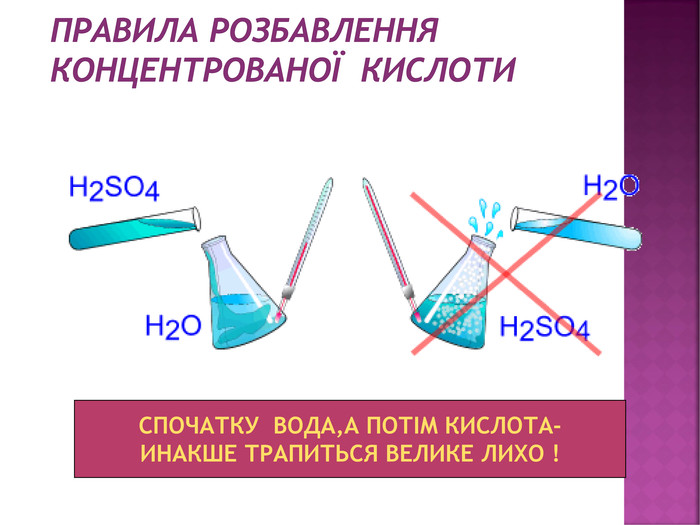
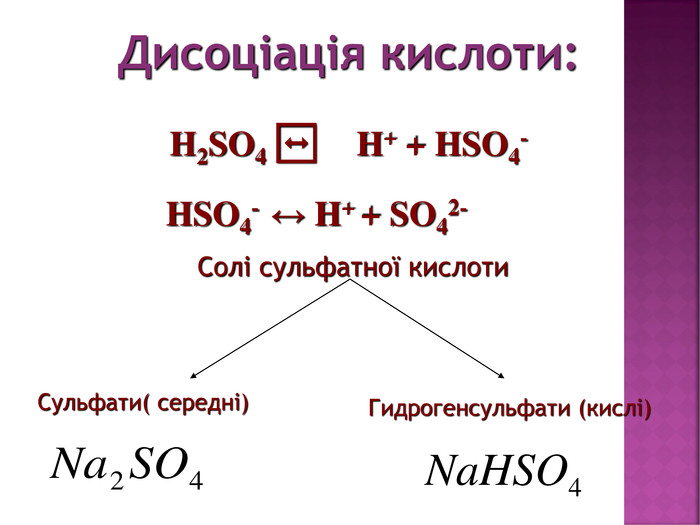
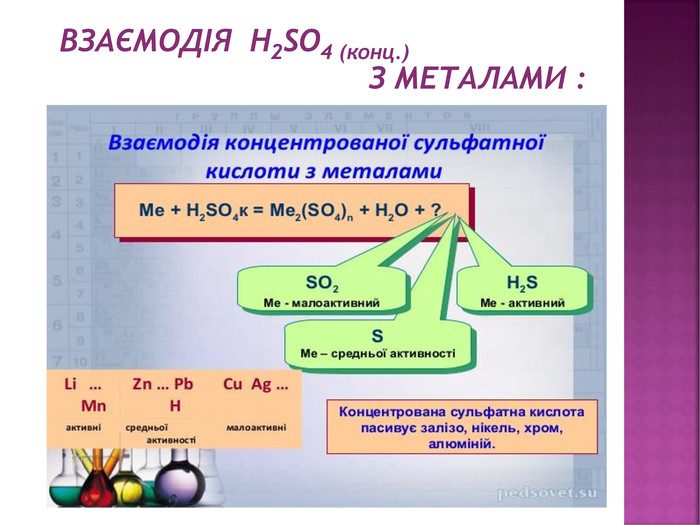
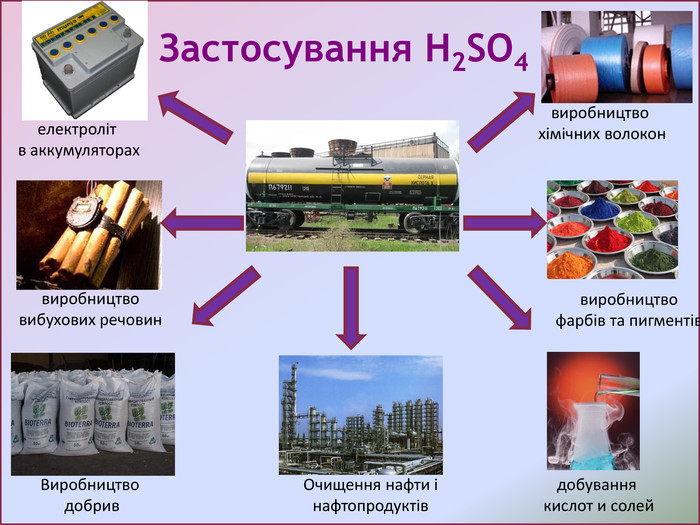
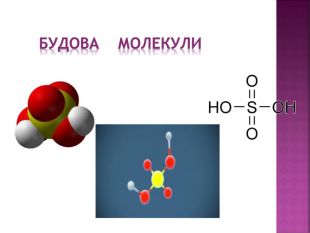
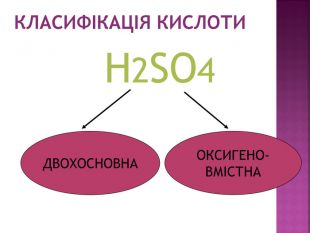
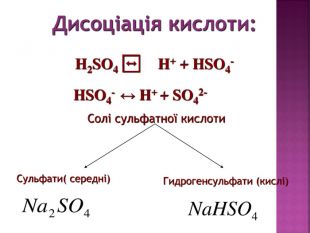
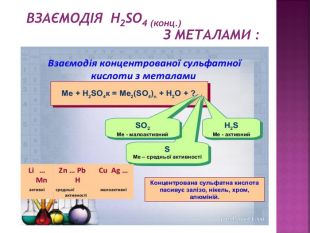
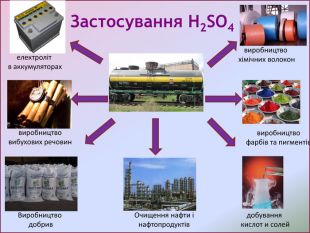
Презентація з хімії на тему "Сульфатна кислота".Матеріал створений для засвоєння теоретичного материалу з теми "Сульфатна кислота" в 11класі (будова молекули, фізичні та хімічні властивості,виробництво та ії застосування). Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
дякую
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку