Презентація "НАТРІЙ І КАЛІЙ"
Про матеріал
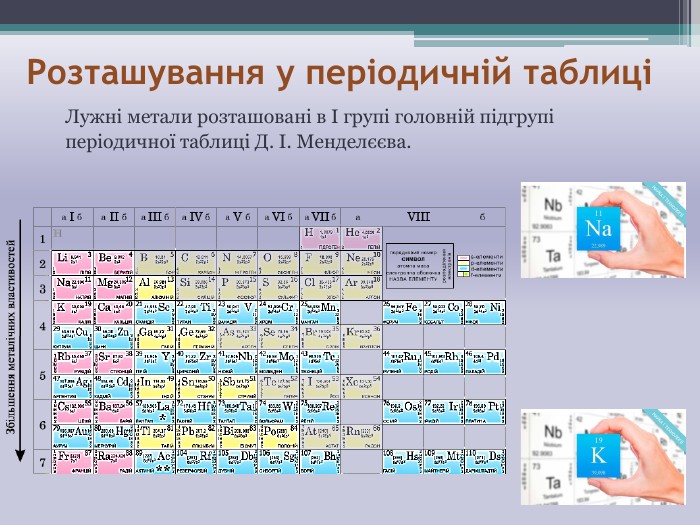
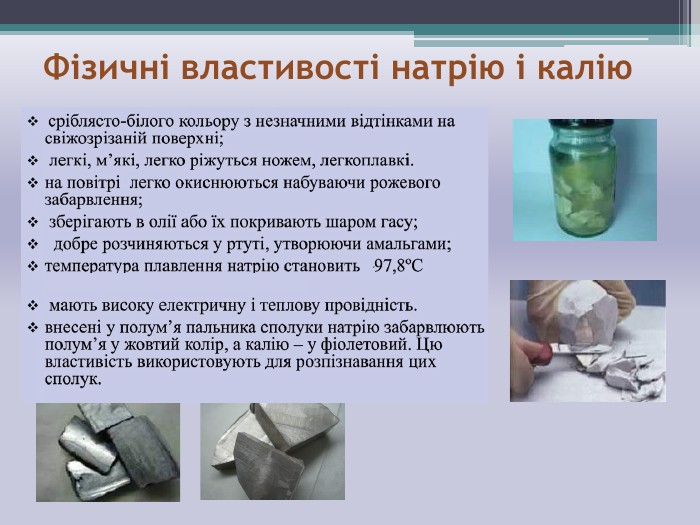
Презентація "НАТРІЙ і КАЛІЙ" до уроку хімії в 11 класі при вивченні теми "Металічні елементи та сполуки, утворені ними" допоможе формувати предметні компетентності, а саме: поглибити знання про лужні метали на прикладі натрію та калію, про будову атомів цих металічних елементів, про фізичні та хімічні властивості та застосування цих металів. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку