Презентація " Основи. Властивості основ"
Про матеріал
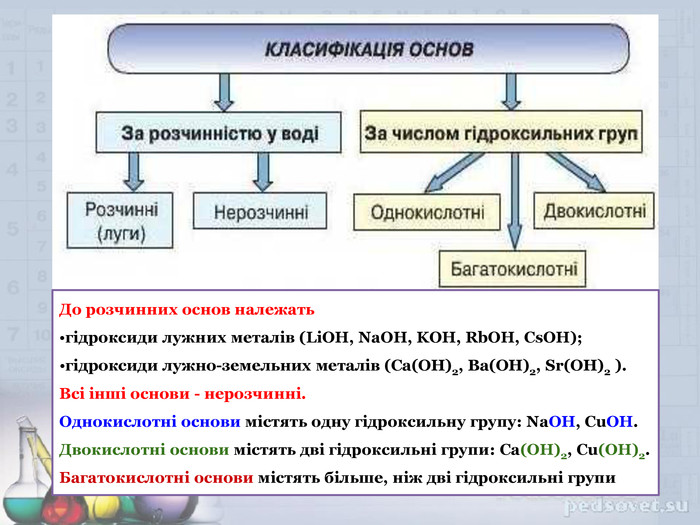
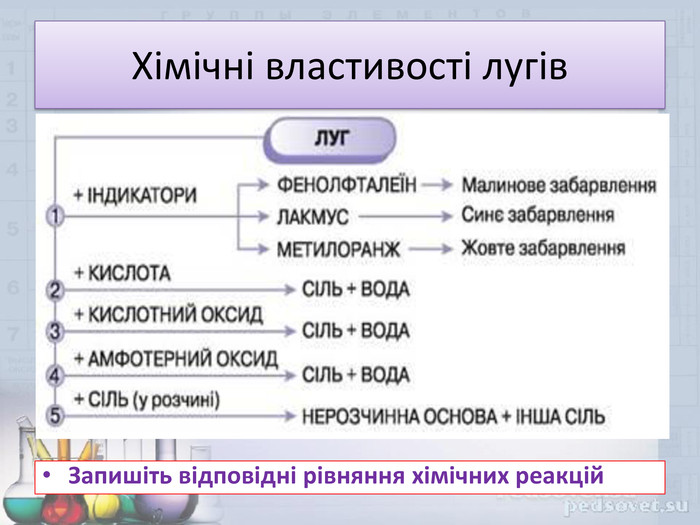
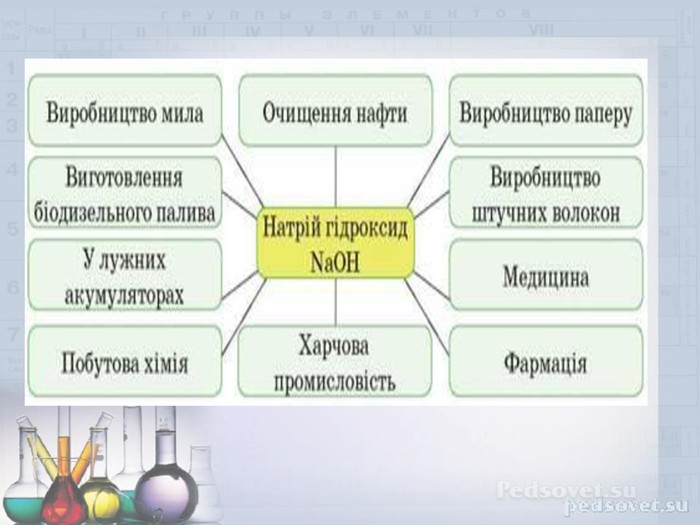
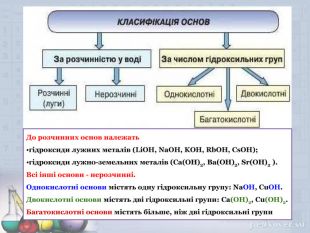
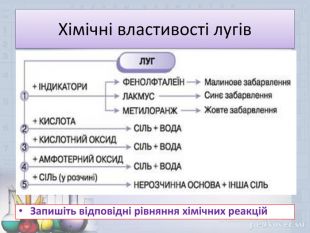
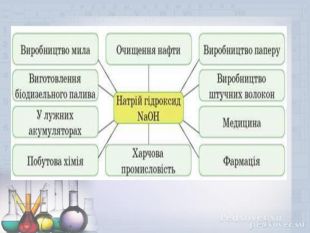
Основи. Властивості основ .Мета презентації: дати поняття про основи, класифікацію, фізичні та хімічні властивості лугів та нерозчинних основ. Закріпити добуті знання . Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку



















-

Супрун Ольга Петрівна
06.12.2023 в 20:12
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Підкалюк Любов Петрівна
09.02.2023 в 19:26
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Обертінська Вікторія
04.03.2021 в 02:20
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Гевел Дар'я Олександрівна
08.04.2020 в 10:52
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 1 відгук