Презентація "Жорсткість води"
Про матеріал
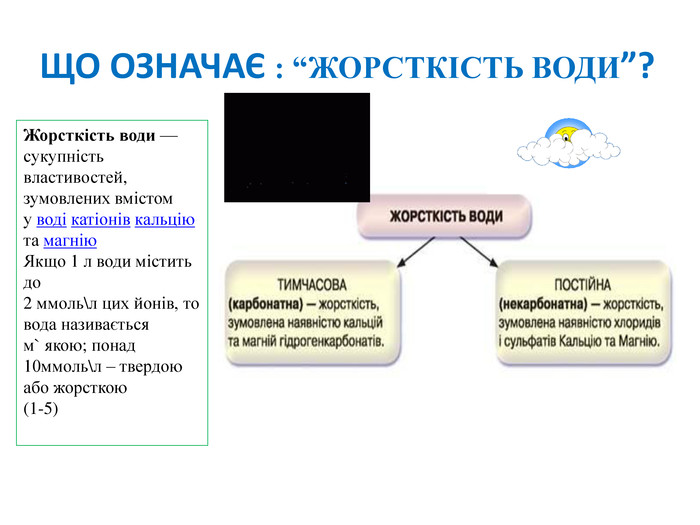
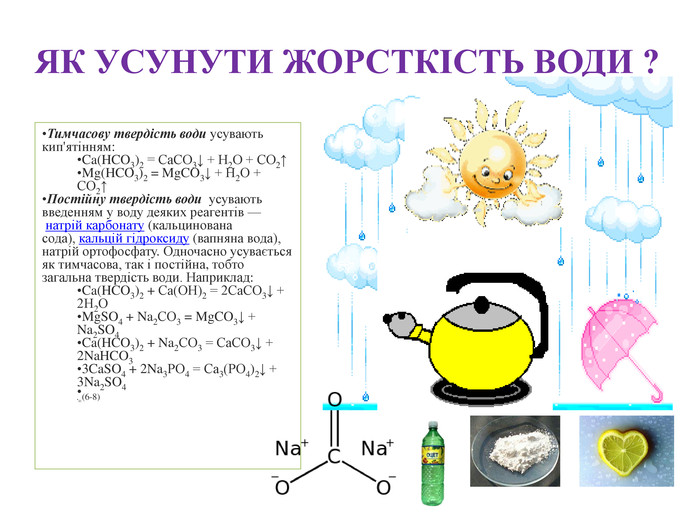
Мета презентації: розвивати компетентнісний образ "Я" через поетапне формування уявлень щодо жорсткості води, гармонійного явища природи, яке свідчить про хімічні закономірності, зв `язки між будовою та властивостями речовин, допомагає людині застосовувати їх у побуті, виробництві. Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку