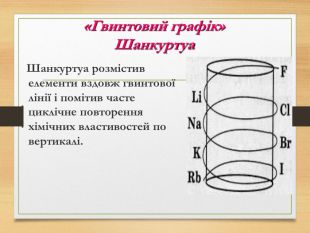
Презентація "Перші спроби класифікації хімічних елементів"
Про матеріал
Презентація "Перші спроби класифікації хімічних елементів" можна використати на уроці хімії відповідної теми у 8 класі. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку