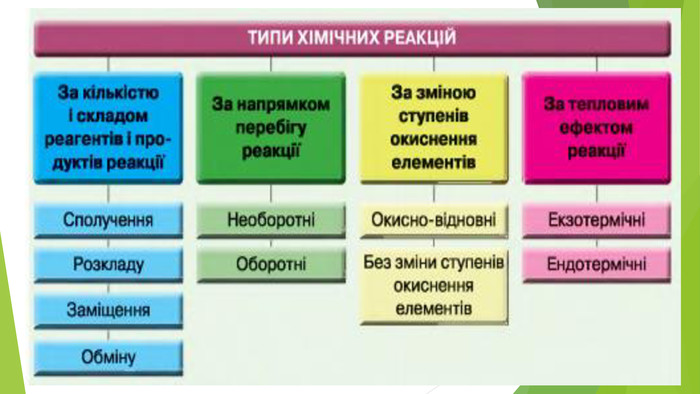
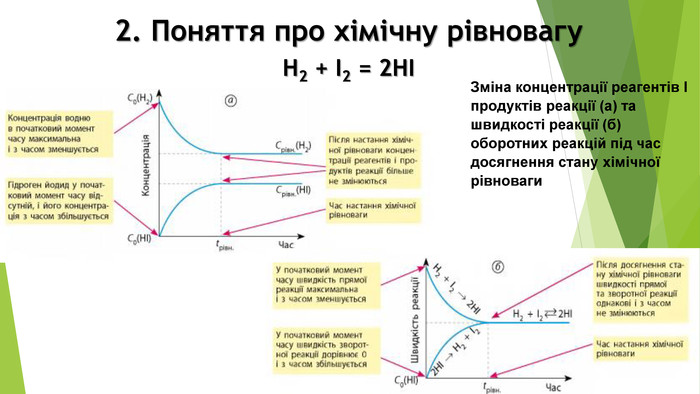
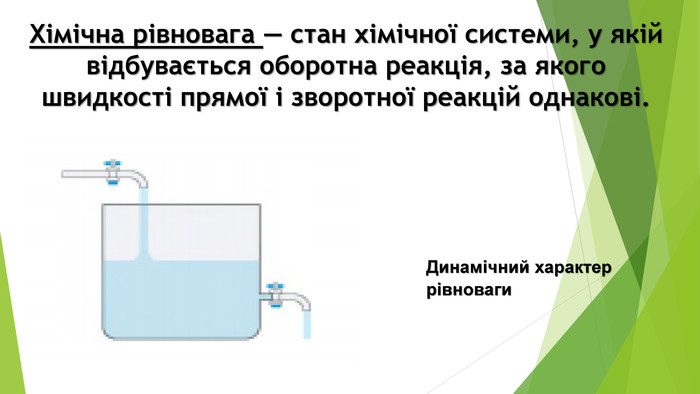
Презентація по темі: "Необоротні та оборотні хімічні процеси. Хімічна рівновага."
Про матеріал
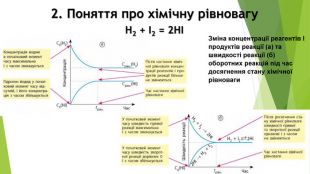
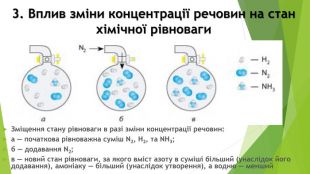
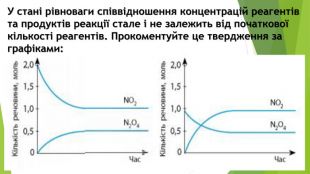
Презентація по темі: "Необоротні та оборотні хімічні процеси. Хімічна рівновага." Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку






















-

Заяць Євдокія Дмитрівна
05.05.2021 в 08:27
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Тризна Елена
27.11.2020 в 13:01
Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Сідало Ольга Яківна
15.11.2020 в 19:26
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Отрощенко Юлія Володимирівна
20.01.2020 в 17:54
Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 1 відгук