Презентація по темі: "Особливості взаємодії металів з нітратною і концентрованою сульфатною кислотами"




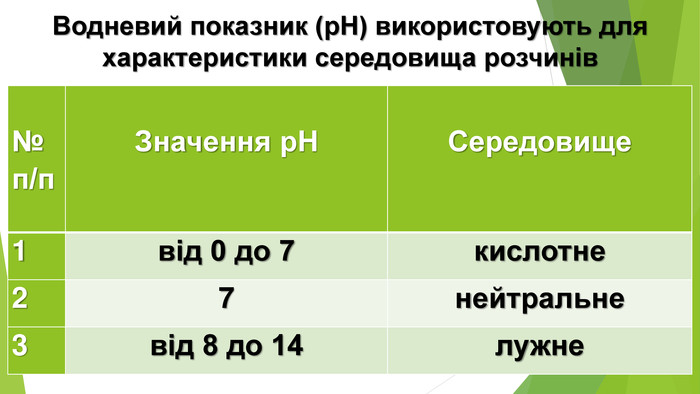







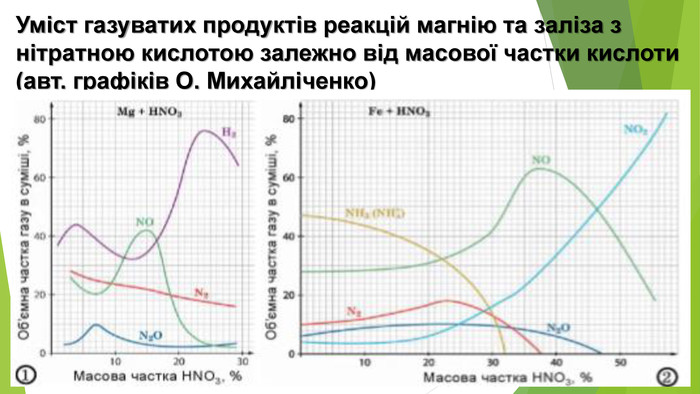
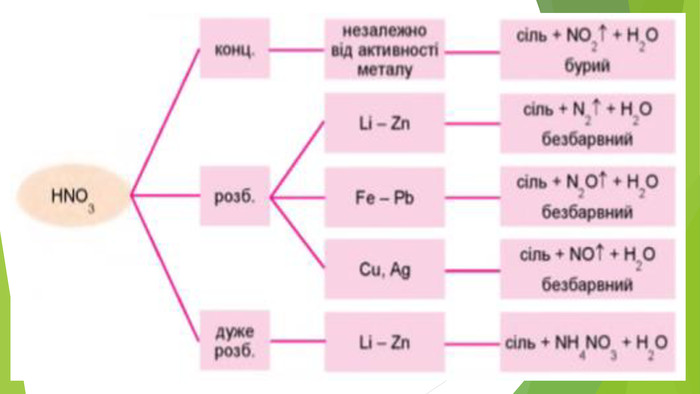









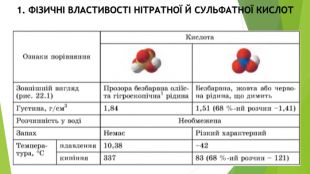
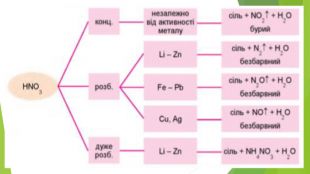
Нітратна кислота — сильний електроліт, у воді повністю дисоціює на йони, тому реакції з її участю в розчинах відбуваються швидко. Окрім цього, вона сильний окисник. У реакціях з металами її окиснювальна дія пов’язана зі зміною ступеня окиснення Нітрогену, водень не виділяється, а окиснюється з утворенням води. У кислоті Нітроген має максимальний ступінь окиснення, що дорівнює +5. У реакціях нітратної кислоти з металами атоми Нітрогену приєднують електрони, тобто виконують функцію окисника, а самі відновлюються. Величина ступеня окиснення Нітрогену у продукті реакції залежить від концентрації кислоти, активності металу, температури. Що менша концентрація кислоти і що активніший метал, то більше Нітроген відновлюється. Під час взаємодії нітратної кислоти з металами серед продуктів реакції буде один із зазначених газоподібних нітрогеновмісних продуктів відновлення Нітрогену.
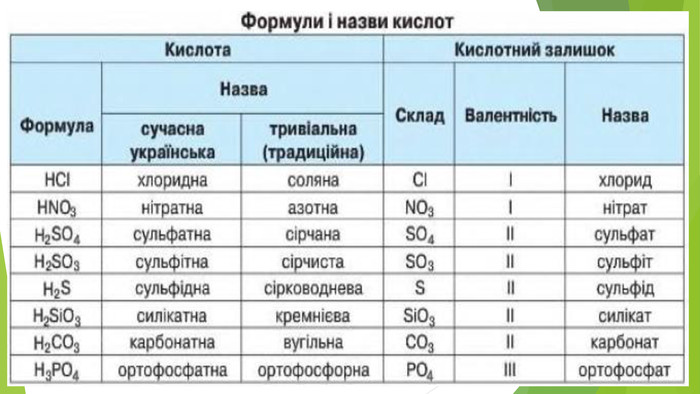
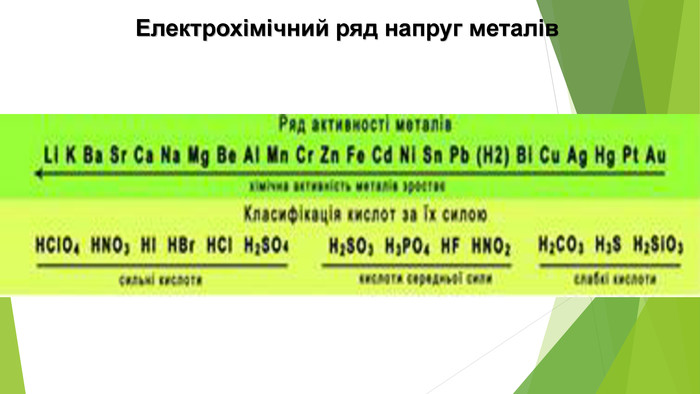
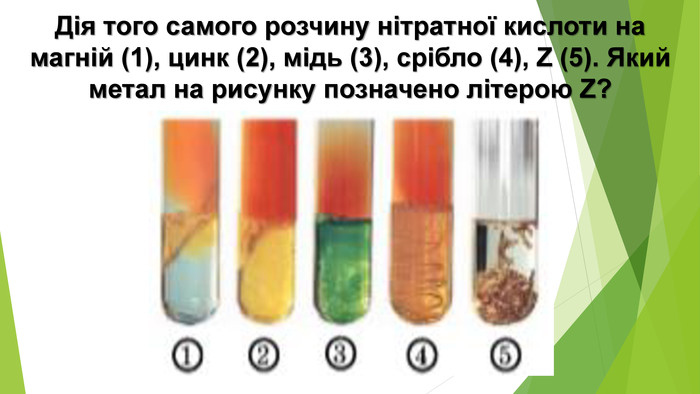
Крім нітрогеновмісного продукту відновлення нітратної кислоти утворюється сіль (нітрат) і вода. Реагенти і продукти взаємодії нітратної кислоти з металами відображено на схемі. Концентрована нітратна кислота під час нагрівання взаємодіє з більшістю металів, крім найбільш хімічно інертних металів (їх ще називають металами платинової групи) — золота, платини, родію та деяких інших. На холоді частина металів, зокрема залізо, хром, алюміній, не взаємодіють з концентрованою нітратною кислотою, тому що на їхній поверхні утворюється захисна плівка з оксидів.
Ці самі метали з розбавленою нітратною кислотою (реакцію прискорює нагрівання) утворюють нітроген(ІІ) оксид NO: Напишемо електронний баланс цієї реакції й порівняємо його з попереднім: Як бачимо, в обох випадках Нітроген, а отже і нітратна кислота, до складу якої він входить, є окисниками.
На відміну від малоактивних металів, хімічно активні метали, наприклад кальцій, залізо, цинк, реагують з утворенням різних нітрогеновмісних продуктів відновлення нітратної кислоти. Усе буде залежати від концентрації кислоти й температури. Розглянемо приклади: Якщо кислота взаємодіє з металом, утворюючи амоніак, і взята з надлишком, то кінцевим продуктом реакції будуть вода і дві солі — нітрат металічного елемента й амоній нітрат:
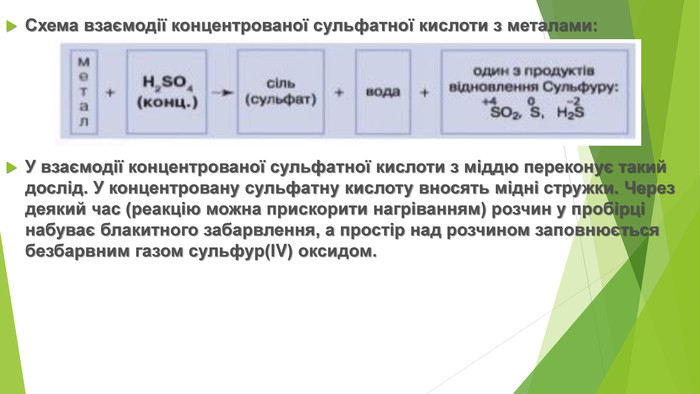
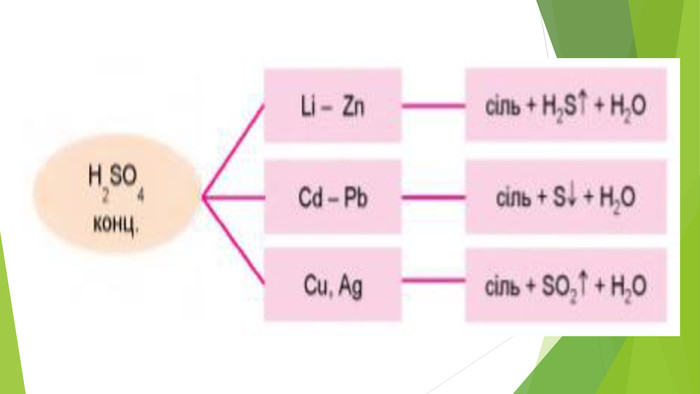
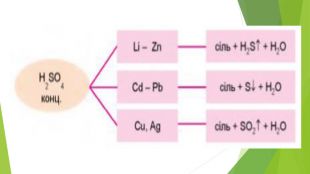
3. ХІМІЧНІ ВЛАСТИВОСТІ КОНЦЕНТРОВАНОЇ СУЛЬФАТНОЇ КИСЛОТИСульфатна кислота — сильний електроліт, у воді повністю дисоціює на йони, тому реакції з її участю в розчинах відбуваються швидко. Розбавлена сульфатна кислота не взаємодіє з міддю, цим вона виявляє загальну властивість кислот відносно металів, що розташовані в ряді активності праворуч від водню. На відміну від розбавленої, концентрована сульфатна кислота є сильним окисником і взаємодіє з ними. Унаслідок взаємодії концентрованої сульфатної кислоти з металами утворюється сіль сульфатної кислоти (сульфат), вода й один із продуктів відновлення Сульфуру.
Схема взаємодії концентрованої сульфатної кислоти з металами: У взаємодії концентрованої сульфатної кислоти з міддю переконує такий дослід. У концентровану сульфатну кислоту вносять мідні стружки. Через деякий час (реакцію можна прискорити нагріванням) розчин у пробірці набуває блакитного забарвлення, а простір над розчином заповнюється безбарвним газом сульфур(ІV) оксидом.
Розглянемо окисно-відновні процеси в цій реакції. Відбулася зміна ступенів окиснення Купруму й Сульфуру. На підставі цього напишемо електронний баланс, установимо коефіцієнти за кількістю відданих і приєднаних електронів, укажемо процеси окиснення і відновлення, окисника і відновника. Взаємодія розбавленої сульфатної кислоти з металами, розташованими в ряді активності ліворуч від водню, теж є окисно-відновним процесом, проте в ньому відновлюється Гідроген, а не Сульфур, ступінь окиснення якого залишається без змін.
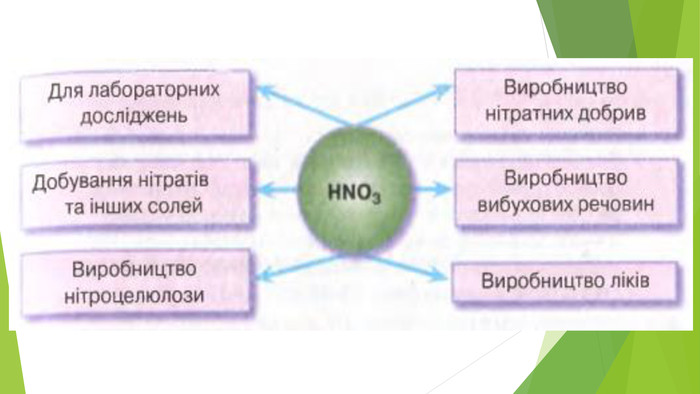
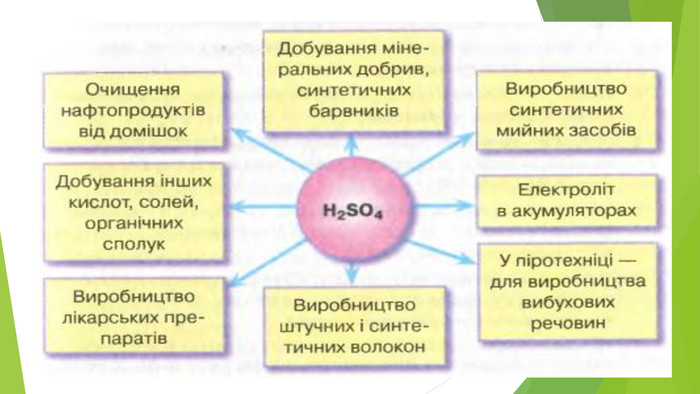
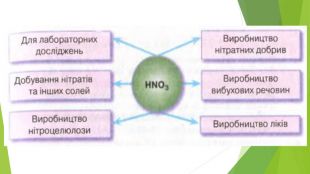
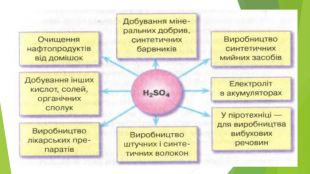
4. ЗАСТОСУВАННЯ HNO3 та H2 SO4. Нітратна кислота й концентрована сульфатна кислота — сильні окисники. Під час їхньої взаємодії з металами утворюється три продукти: сіль, вода й продукт відновлення кислоти. Нітратна й сульфатна кислоти широко використовуються у промисловості, виробництві добрив, тканин тощо. В удосконалення технології їхнього виробництва зробили внесок вітчизняні вчені І. Є. Ададуров і В. І. Атрощенко.
Іван Євграфович Ададуров (1879-1938)Іван Євграфович Ададуров (1879-1938) — удосконалив технологію виробництва сульфатної та нітратної кислот, а також технологію приготування каталізаторів для процесів окиснення сульфур(І\/) оксиду й амоніаку. За його участі з ’явилися цехи контактного виробництва сульфатної кислоти, цинкових білил, натрій сульфіту на Костянтинівському хімічному заводі. Багато зусиль учений доклав до підготовки висококваліфікованих фахівців для хімічної промисловості. У 1928-1933 рр. І. Є. Ададуров завідував кафедрою основної хімічної технології Одеського хіміко-технологічного інституту. У 1933-1938 рр. працював завідувачем кафедри технології неорганічних речовин Харківського хіміко-технологічного інституту. Водночас він читав курс каталізу в Харківському університеті.
Василь Іванович Атрощенко (1906-1991)Василь Іванович Атрощенко (1906-1991) удосконалив технологію виробництва нітратної кислоти з азоту повітря, досліджував окиснення амоніаку контактним методом, що е однією зі стадій у виробництві нітратної кислоти, вивчав адсорбцію оксидів Нітрогену, конструював адсорбційні апарати.
1. Схарактеризуйте фізичні властивості нітратної та сульфатної кислот. Яких засобів безпеки слід дотримуватися під час роботи з ними? 2. У чому полягають особливості хімічних властивостей нітратної кислоти? 3. Назвіть можливі продукти відновлення Нітрогену в реакціях нітратної кислоти з металами та Сульфуру в реакціях концентрованої сульфатної кислоти з металами. 4. Чим відрізняються взаємодії з металами концентрованої й розбавленої сульфатної кислоти?5. Складіть план дослідження з розпізнавання концентрованої й розбавленої сульфатної кислоти. Спрогнозуйте очікувані результати. 6. Укажіть правильне твердження щодо нітратної кислоти. А) Нітроген у її молекулі має ступінь окиснення –З; Б) сильний окисник; В) добре розчиняється у воді; Г) не взаємодіє з міддю.7. Укажіть назви речовин, з якими реагує концентрована сульфатна кислота. А) водень; Б) мідь; В) барій хлорид; Г) кисень.8. Укажіть правильне твердження. А) концентрована нітратна кислота взаємодіє з цинком з виділенням нітроген(ІІ) оксиду; Б) у реакції дуже розбавленої нітратної кислоти з магнієм ступінь окиснення Нітрогену змінюється від +5 до –З; В) нітратна й сульфатна кислоти погано розчиняються у воді; Г) концентрована сульфатна кислота реагує з металами з виділенням водню.
9. Укажіть схему, у якій атом Нітрогену приєднує 5 електронів.10. Використовуючи метод електронного балансу, перетворіть схему в рівняння реакції, розгляньте окисно-відновні процеси. Zn + H2 SO4 (конц.) —> А + Б + SO2 11. Обчисліть, чи вистачить міді масою 32 г для одержання купрум(ІІ) нітрату, якщо для реакції використати концентровану нітратну кислоту масою 600 г з масовою часткою розчиненої речовини 50 %.12. Обчисліть об'єм газу (н. у.), що виділиться під час розчинення міді масою 1,28 г у концентрованій сульфатній кислоті. 13. У розчин масою 500 г із масовою часткою сульфатної кислоти 4,8 % насипали порошок заліза масою 22,4 г. Обчисліть об'єм газу (н. у), що виділився. 14. Обчисліть масу сульфур(УІ) оксиду, яку можна добути окисненням сульфур(ІV) оксиду об'ємом 560 л (н. у.), якщо відносний вихід продукту реакції становить 85 %.


про публікацію авторської розробки
Додати розробку























-

Пась Любов Григорівна
13.02.2024 в 07:27
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Пась Любов Григорівна
13.02.2024 в 07:27
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Мельник Людмила Василівна
10.12.2023 в 16:13
супер ,дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Шевченко Світлана Василівна
30.01.2021 в 22:29
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Пелих Михайло
28.01.2021 в 18:20
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Підкалюк Любов Петрівна
11.01.2021 в 20:33
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Гимназия Гимназия
10.12.2020 в 15:22
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 4 відгука