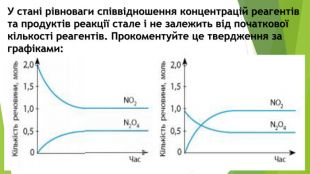
Презентація по темі: "Принцип Ле Шательє"
Про матеріал
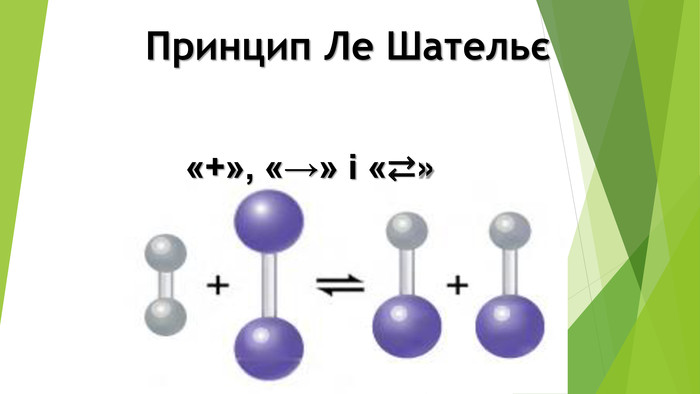
Презентація по темі: "Принцип Ле Шательє".
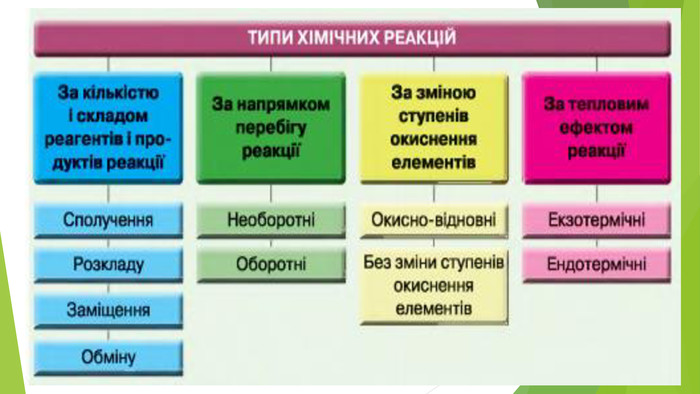
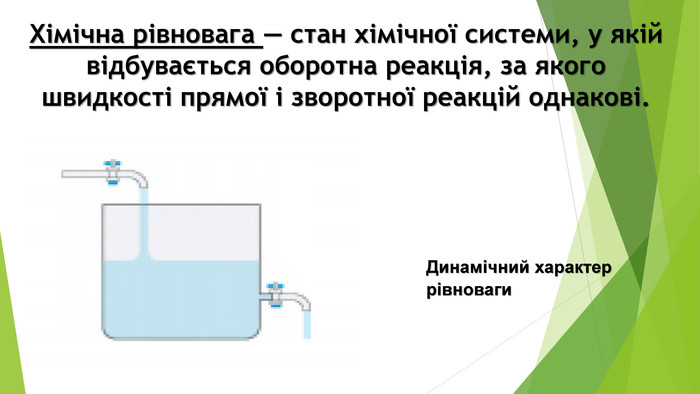
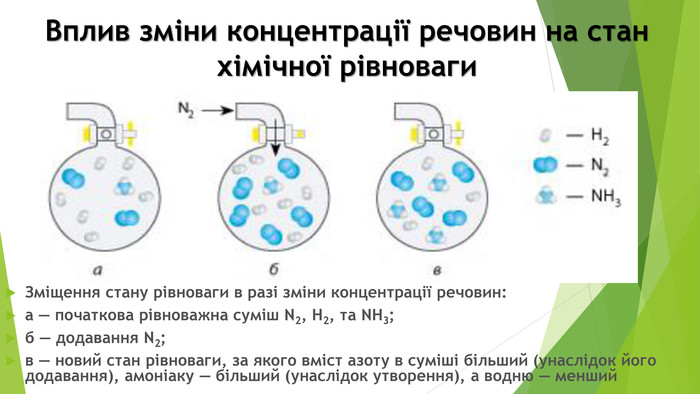
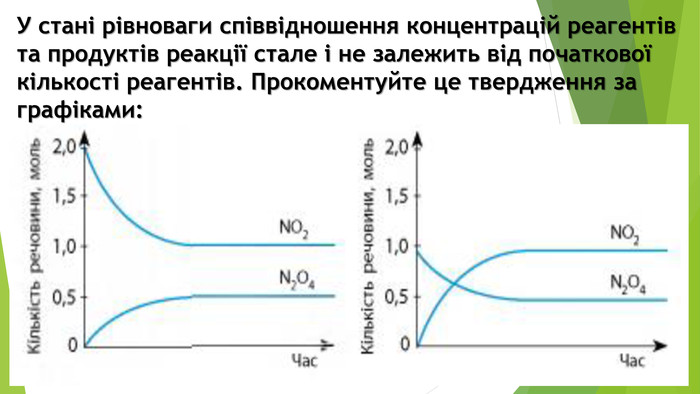
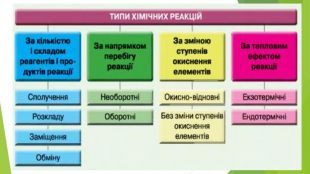
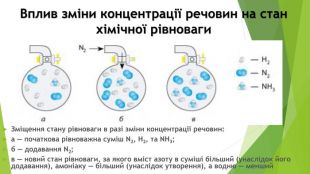
Включає повторення попереднього матеріалу про оборотні та необоротні хімічні реакції, хімічну рівновагу. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку