Презентація по темі: "Загальна характеристика металів"



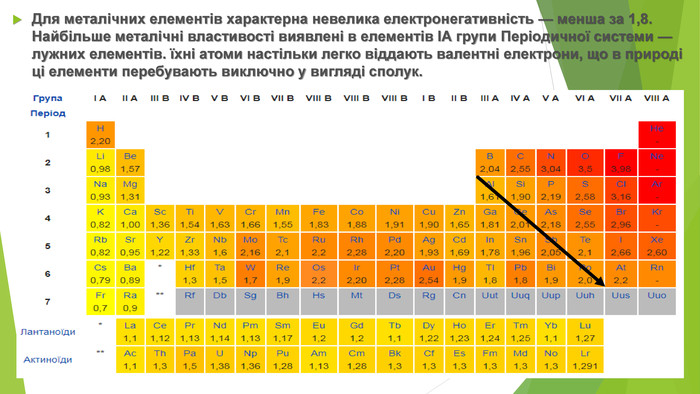















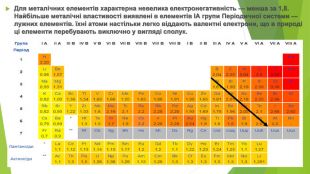
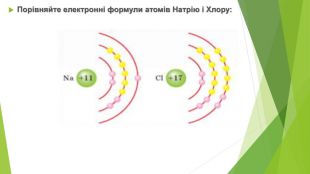
Зі 118 хімічних елементів, відомих на сьогодні, близько 100 елементів є металічними. У Періодичній системі вони розташовані від початку кожного періоду, а також у двох родинах f-елементів: Лантаноїди та Актиноїди. В атомів металічних елементів на зовнішньому енергетичному рівні міститься невелике число електронів: • у s-елементів — один або два; • у d-елементів — два (як виняток — один); • у р-елементів по-різному: в елементів 3-5 періодів — по 3-4 електрони, в елементів 6-7 періодів значно більше, але через значне віддалення від ядра вони слабко притягаються до нього. Атоми металічних елементів у хімічних взаємодіях лише віддають електрони та, як наслідок, набувають стійкої електронної конфігурації атомів найближчого інертного елемента. Отже, метали в хімічних реакціях є виключно відновниками. У цьому полягає їх принципова відмінність від неметалів.
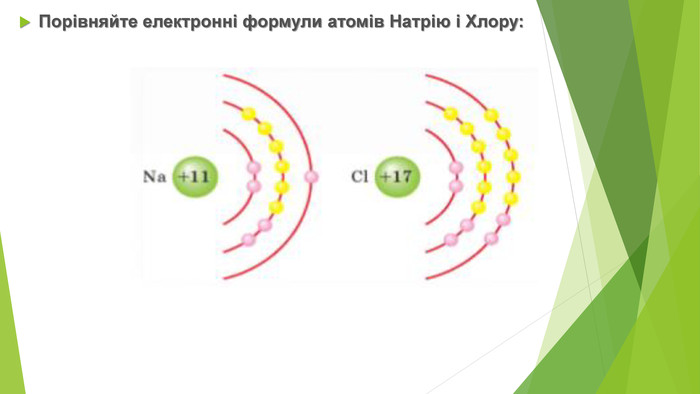
Для металічних елементів характерна невелика електронегативність — менша за 1,8. Найбільше металічні властивості виявлені в елементів ІА групи Періодичної системи — лужних елементів. їхні атоми настільки легко віддають валентні електрони, що в природі ці елементи перебувають виключно у вигляді сполук.
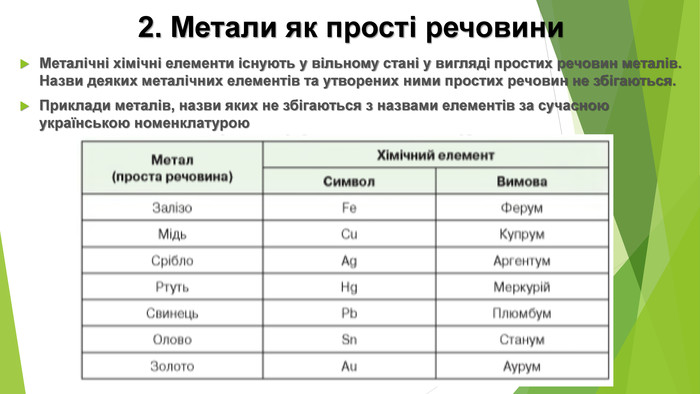
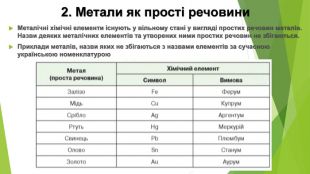
2. Метали як прості речовини. Металічні хімічні елементи існують у вільному стані у вигляді простих речовин металів. Назви деяких металічних елементів та утворених ними простих речовин не збігаються. Приклади металів, назви яких не збігаються з назвами елементів за сучасною українською номенклатурою
{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}Тип кристалічних граток. Характеристика Тип зв’язку Приклади речовин. Фізичні властивостіМолекулярна У вузлах кристалічних граток знаходяться полярні або неполярні молекули, зв’язані між собою слабкими силами електростатичного притягання Ковалентний Вода, амоніак, більшість органічних сполук. Невисокі температури плавлення й кипіння, нетверді, діелектрики, розчинні (з полярним типом зв’язку) і нерозчинні (з неполярним типом зв’язку), гази або рідини за кімнатної температури Атомна. У вузлах атомних кристалічних граток розміщені атоми, зв’язані між собою спільними електронними парами. Ковалентний неполярний. Алмаз, кремній, силіцій Високі температури плавлення й кипіння, тверді, крихкі, діелектрики або напівпровідники, нерозчинніЙонна У вузлах йонних кристалічних граток почергово розташовані позитивно й негативно заряджені йони. Йонний Більшість солей, оксидів, основ. Високі температури плавлення й кипіння, тверді, крихкі, діелектрики, у водних розчинах і розплавах – провідники, розчинніМеталічна. У вузлах металічних кристалічних граток поряд із нейтральними атомами розміщаються заряджені йони металів. Металічний Метали, сплави. Різні температури плавлення й кипіння, переважно високі, тверді, пластичні, провідники, нерозчинні у воді
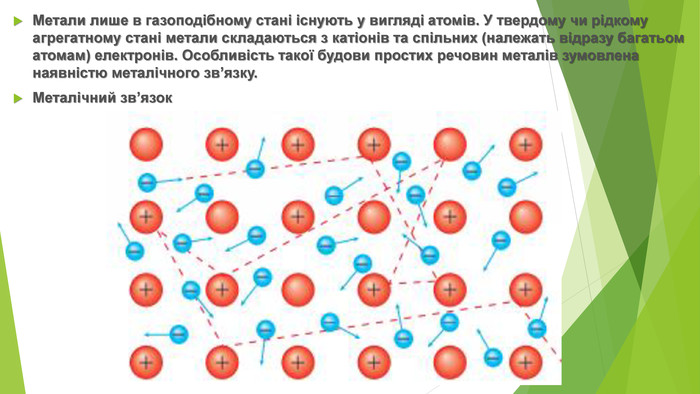
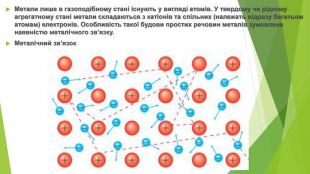
Метали лише в газоподібному стані існують у вигляді атомів. У твердому чи рідкому агрегатному стані метали складаються з катіонів та спільних (належать відразу багатьом атомам) електронів. Особливість такої будови простих речовин металів зумовлена наявністю металічного зв’язку. Металічний зв’язок
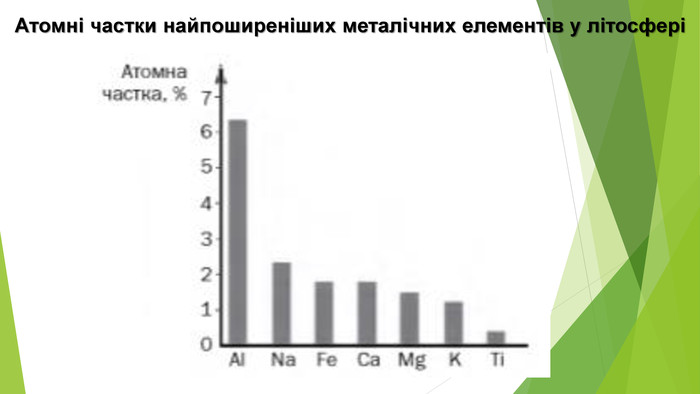
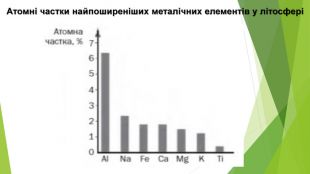
3. Поширеність металічних елементів у природіСлово «метал» походить від грецького metallon, що означає «рудник» або «шахта». Мінерали й гірські породи, які містять сполуки металічних елементів і придатні для добування металів промисловим способом, називають рудами: залізна руда, алюмінієва, мідна, свинцева тощо. Найпоширеніший у земній корі металічний елемент — Алюміній (7%), він поступається лише двом неметалічним — Оксигену й Силіцію. Друге місце серед металічних елементів посідає Ферум (4%); Третє — Кальцій (3%), потім Натрій, Калій і Магній (близько 2%), Титан (0,6%). Набагато менше в земній корі Хрому (0,01%), Купруму (0,005%), Урану, Стануму (близько 0,0002%), Аргентуму (0,000007 %), Меркурію (0,000005%), Ауруму (0,0000001%). Усі радіоактивні металічні елементи (за винятком Урану й Торію) у природі наявні в незначних кількостях або взагалі не виявлені.
• Металічний блиск У компактному вигляді (пластинка, згусток з гладенькою поверхнею) металам властивий металічний блиск. Він є наслідком відбиття світла від їх поверхні. Ця фізична властивість найкраще проявляється в срібла. Блиск металів здебільшого сріблястий, хоча в цезію і золота — жовтий, у міді — цегляно-червоний. Пластинки, виготовлені з різних металів: а — міді; б — алюмінію; в — золота; г — цинку
• Колір За кольором усі метали майже однакові: сріблясто-сірі, можуть бути дещо темнішими або світлішими. Усі мають металічний блиск (більшою чи меншою мірою). Деякі метали мають світло-блакитний відтінок. Лише трьом металам властиве характерне забарвлення: золото — жовте, мідь — червона, цезій — світло-жовтий. Цезій — один із трьох металів, що мають характерне забарвлення
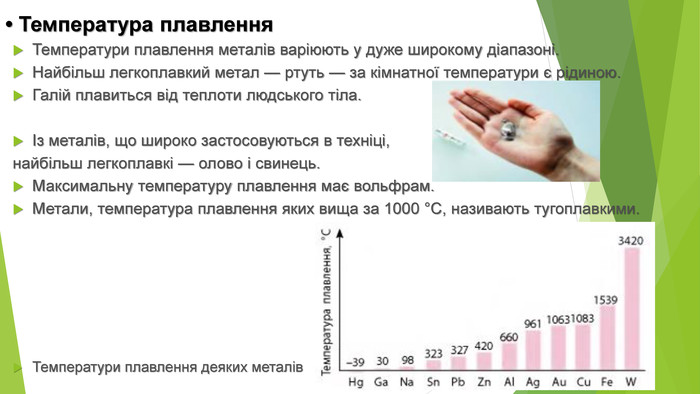
• Температура плавлення Температури плавлення металів варіюють у дуже широкому діапазоні. Найбільш легкоплавкий метал — ртуть — за кімнатної температури є рідиною. Галій плавиться від теплоти людського тіла. Із металів, що широко застосовуються в техніці, найбільш легкоплавкі — олово і свинець. Максимальну температуру плавлення має вольфрам. Метали, температура плавлення яких вища за 1000 °С, називають тугоплавкими. Температури плавлення деяких металів
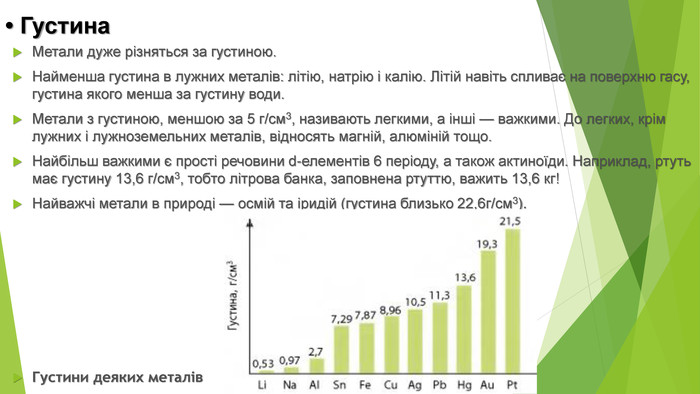
• Густина. Метали дуже різняться за густиною. Найменша густина в лужних металів: літію, натрію і калію. Літій навіть спливає на поверхню гасу, густина якого менша за густину води. Метали з густиною, меншою за 5 г/см3, називають легкими, а інші — важкими. До легких, крім лужних і лужноземельних металів, відносять магній, алюміній тощо. Найбільш важкими є прості речовини d-елементів 6 періоду, а також актиноїди. Наприклад, ртуть має густину 13,6 г/см3, тобто літрова банка, заповнена ртуттю, важить 13,6 кг! Найважчі метали в природі — осмій та іридій (густина близько 22,6г/см3). Густини деяких металів
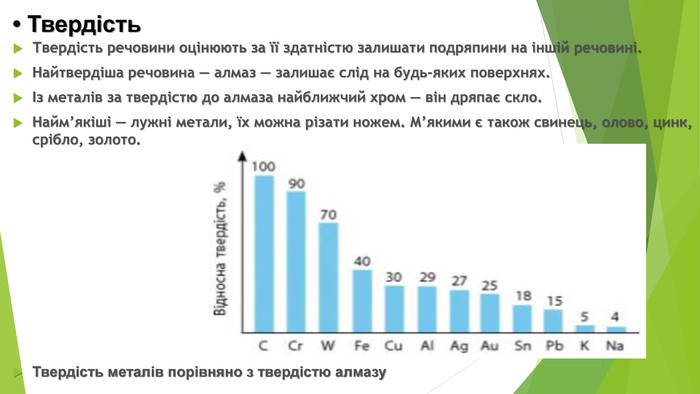
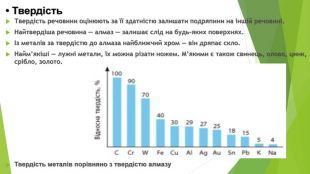
• Твердість Твердість речовини оцінюють за її здатністю залишати подряпини на іншій речовині. Найтвердіша речовина — алмаз — залишає слід на будь-яких поверхнях. Із металів за твердістю до алмаза найближчий хром — він дряпає скло. Найм’якіші — лужні метали, їх можна різати ножем. М’якими є також свинець, олово, цинк, срібло, золото. Твердість металів порівняно з твердістю алмазу
Цікаво, що…Швейцарська фірма Valcambi випускає золоті зливки Combibary формі, що нагадує плитку шоколаду. Головна їхня перевага перед звичними зливками полягає в тому, що таку плитку можна легко розламати на частинки масою 1 грам і використовувати як подарунок або альтернативний платіжний засіб. Крім золота, компанія випускає подібні вироби зі срібла, платини та паладію.
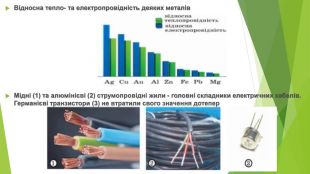
• Електро- та теплопровідність. Усі метали добре проводять електричний струм. Найбільша електропровідність у срібла, дещо менша — у міді й золота. Але срібло — це дорогий метал, його використовують лише для виготовлення високоточних приладів. У побуті застосовують переважно мідні дроти, вони мають значно кращі характеристики, ніж дроти, виготовлені з алюмінію. Під час проходження через метал електричного струму частина енергії перетворюється на теплову — метал нагрівається. Використання алюмінієвих дротів за високих навантажень на електричну мережу може призвести до їх розплавлення. Особливо небезпечними є місця контакту алюмінієвих і мідних дротів — вони нагріваються набагато швидше, що може спричинити пожежу. Електропровідність металів залежить від числа вільних електронів у кристалі. Крім того, чим більше в металі вільних електронів, тим швидше відбувається вирівнювання температури в усьому кристалі, тобто тим більша його теплопровідність. Тому для багатьох металів близькими є відносні значення тепло- й електропровідності.
• Пластичність (ковкість) Багато металів пластичні, тобто можуть змінювати форму без руйнування, наприклад, розплющуватися від удару молотом. Найбільш пластичними є золото, срібло, мідь, олово. їх можна розкатувати в тонку фольгу. Прокаткою можна одержати шари золота завтовшки декілька атомів. Саме такі золоті лусочки використав Резерфорд під час дослідження будови атома. Зовні вони нагадують напівпрозору зеленувату плівку, що пропускає світло. Ще за часів Київської Русі найтоншу золоту фольгу (сухозлітне золото) застосовували для золочення виробів із деревини і кераміки. Тонким золотом прикрашали рукописні книги та ікони. Зі злитка золота масою лише 1 г можна витягнути дріт завдовжки майже 3 км або виготовити лист фольги площею 1 м2.1. Дріт і трубка виготовлені з міді. 2. Магнієва стрічка. 3. Срібна (Ag 925) ювілейна монета «Тисячоліття монетного карбування в Києві». 4. Золота фольга 0,00001 мм завтовшки
5. Застосування. Найважливішими для практики металами є залізо, алюміній, мідь, цинк. Вони набули широкого використання завдяки стійкості до природних умов і поширеності природної сировини, з якої їх добувають. Золото, срібло, платина — дорогоцінні метали. З них виготовляють ювелірні вироби, прикраси, іноді карбують монети. Ці метали також застосовують у хімічній промисловості, приладобудуванні, електронній техніці. Вироби з металів. 1. Золоту (Аu 999,9) монету присвячено важливій спортивній події - Фінальному турніру чемпіонату Європи з футболу, який було проведено в Україні та Польщі у 2012 році. 2. Пам’ятну монету зі срібла 925 проби присвячено 150-річчю від дня народження української письменниці - Дніпрової Чайки (Людмили Олексіївни Василевської), яка написала чимало оповідань і віршів, створила лібрето багатьох дитячих опер, зокрема «Коза-дереза», «Пан Коцький», «Зима й весна» Миколи Лисенка. 3. Бляшанки виготовляють зі сталі (сплаву заліза), укритої тонким шаром олова. 4. Мідний кіт-флюгер завжди знає, звідкіля вітер дме.
6. Сплави металів Значно частіше за метали використовують їх сплави. Кожний сплав є однорідною сумішшю (твердим розчином), яку виготовляють шляхом сумісного сплавляння металів із подальшим охолодженням. За фізичними властивостями сплави відрізняються від металів, що входять до їх складу. Вони мають, як правило, нижчі температури плавлення порівняно з відповідними металами, а також інші твердість і густину. Однак сплавам, як і чистим металам, властиві металевий блиск, висока електропровідність. У хімічних реакціях сплави зазвичай поводяться як суміші металів. Учені добувають і досліджують сплави з метою покращення властивостей металів. Так, звичайне залізо швидко ржавіє, а сплави цього металу із хромом і нікелем дуже стійкі у природних умовах. Для виготовлення ювелірних прикрас використовують не чисті дорогоцінні метали, а їх твердіші сплави з міддю і сріблом. Срібна монета
За допомогою припою — сплаву олова зі свинцем — легше паяти (tпл. припою 180 °С), ніж чистими металами — оловом (tпл. 232 °С) чи свинцем (tпл. 327 °С). Сплави металів використовують у хімічній та харчовій промисловості, літако- і машинобудуванні, техніці, будівництві, монументальному мистецтві, побуті. Використання сплавів: а — обладнання з нержавіючої сталі; б — монумент із бронзи; в — вироби з латуні; г — столовий набір із мельхіору
1. Яких елементів — металічних чи неметалічних — більше у 3-му періоді, 4-му періоді? 2. Назвіть групу періодичної системи, в якій розміщені лише металічні елементи. 3. Запишіть електронні формули атома і йона Берилію. 4. Які фізичні властивості є типовими для металів? Поясніть, чому метали проводять електричний струм.5. Чому найчастіше використовують не самі метали, а їх сплави? 6. За матеріалами з інтернету або інших джерел інформації підготуйте повідомлення про метал або сплав з особливими властивостями та його застосування. 7. Зразок спеціальної бронзи має такі масові частки металів (у відсотках): Сu— 85, Sn — 9, Zn — 6. Атомів якого елемента у бронзі найменша кількість? Скільки атомів Купруму припадає у сплаві на кожні 10 атомів цього елемента?8. Порошок силуміну (сплав алюмінію із силіцієм) масою 5 г із масовою часткою силіцію 14 % спалили в надлишку кисню. Обчисліть масові частки оксидів у добутій суміші сполук.9. . Які характерні особливості металічних елементів? 10. У якій частині Періодичної системи розміщені металічні елементи? 11. Схарактеризуйте поширеність металічних елементів у природі. 12. Схарактеризуйте загальні властивості металів. Чим вони зумовлені? 13. Наведіть приклади металів із високими і низькими значеннями тепло- й електропровідності. 14. Які метали називають тугоплавкими, легкими, важкими? Наведіть приклади.


про публікацію авторської розробки
Додати розробку




















-

Смакоуз Тамара Василівна
25.02.2024 в 08:56
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Абарбарчук Вікторія Василівна
16.02.2024 в 09:18
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Гурєєва Ольга В'ячеславівна
12.01.2024 в 16:28
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Підкалюк Любов Петрівна
27.01.2023 в 08:17
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Товстолес Лариса
27.01.2023 в 07:54
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Велика Наталія Миколаївна
13.12.2022 в 19:56
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Виноградова Оксана Михайлівна
11.04.2022 в 23:19
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Фесенко Надежда
07.04.2022 в 09:49
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Лобань Світлана Миколаївна
04.04.2022 в 08:21
ДЯКУЮ!!!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Гарбарчук Ольга Анатоліївна
09.02.2022 в 20:17
дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Гура Ірина Сергіївна
11.01.2022 в 11:10
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Паращак Наталія Миколаївна
12.01.2021 в 11:41
Дякую, за корисний матеріал)
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
Показати ще 9 відгуків