Презентація по темі: "Залежність фізичних властивостей речовин від їхньої будови"
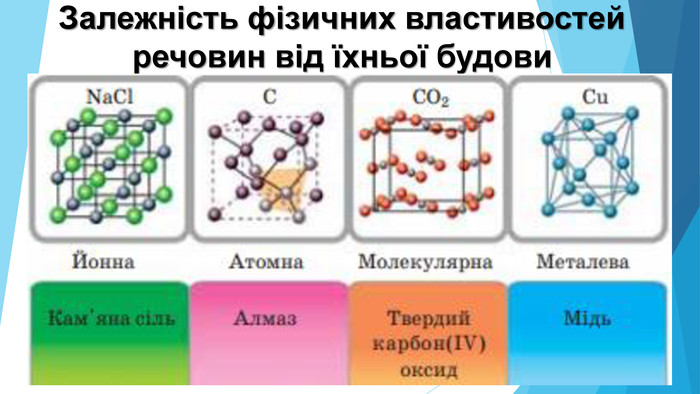





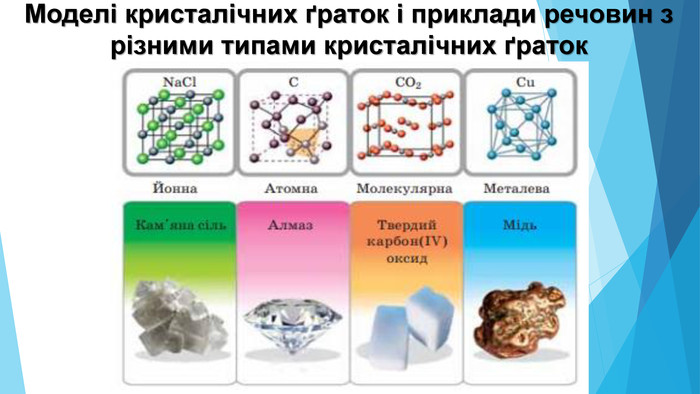
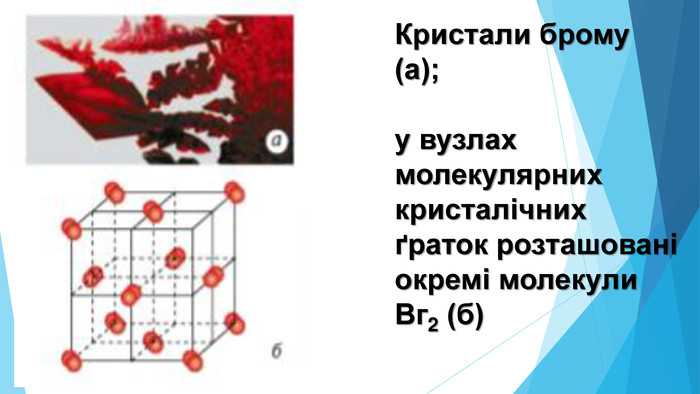
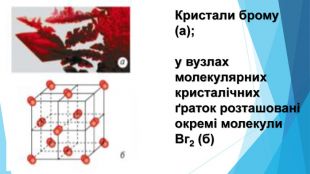
![Модель внутрішньої будови кристала називають кристалічними ґратками. Це — схема чи макет розміщення найменших частинок у невеликому об’ємі кристала. Відповідно до будови речовин розрізняють йонні, молекулярні та атомні кристалічні ґратки. Берил Al2 Be3[Si6018] Модель внутрішньої будови кристала називають кристалічними ґратками. Це — схема чи макет розміщення найменших частинок у невеликому об’ємі кристала. Відповідно до будови речовин розрізняють йонні, молекулярні та атомні кристалічні ґратки. Берил Al2 Be3[Si6018]](/uploads/files/488081/126618/138163_images/12.jpg)







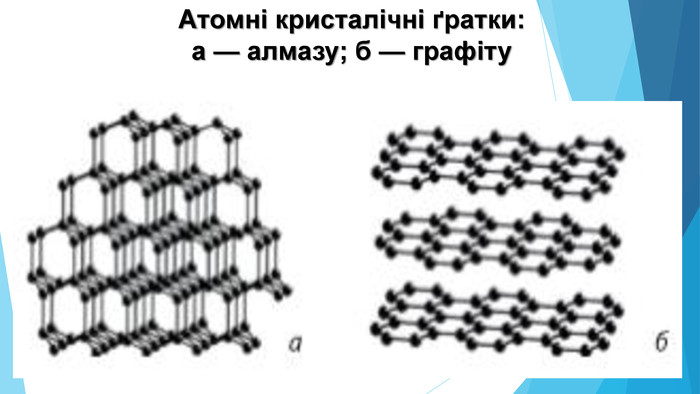



Тест-контроль1. Унаслідок утворення хімічного зв’язку між двома атомами Нітрогену: а) енергія поглинається; б) енергія виділяється;. в) енергія спочатку поглинається, потім – виділяється; г) енергія спочатку виділяється, потім - поглинається. 2. Унаслідок утворення хімічного зв’язку між двома атомами Нітрогену утворюється спільна електронна оболонка. Вона подібна до електронної оболонки атома: а) Гелію, б) Оксигену, в) Неону, г) Літію 3. Ковалентний зв’язок між атомами X-Y виникає за рахунок:а) переходу електрона від Y до X, б) сил електростатичного притягання між атомами Х та Y, в) перекривання атомних орбіталей атомів X та Y, г) переходу пари електронів від Y до X. 4. Ковалентним зв’язком сполучені атоми: а) лужних елементів, б) металічних елементів, в) неметалічних елементів, г) інертних елементів. 5. Ковалентним зв’язком сполучені атоми: а) Натрію, б) Сульфуру й Флуору, в) Неону, г) Натрію й Хлору. 6. У якій речовині два типи хімічного зв’язку - йонний і ковалентний: а) S03, б) Mg. F2, в) КОН, г) H2 S04.7. Укажіть аморфну речовину:а) кухонна сіль, б) бурштин, в) алмаз, г) йод. 8. Укажіть речовину з молекулярними кристалічними ґратками: а) вода, б) натрій хлорид, в) алмаз, г) графіт.9. Укажіть речовину з атомними кристалічними ґратками:а) сахароза, б) алмаз, в) карбон(ІV) оксид, г) калій бромід. 10. Укажіть речовину з йонними кристалічними ґратками: а) вода, б) графіт, в) карбон(ІV) оксид, г) магній оксид.
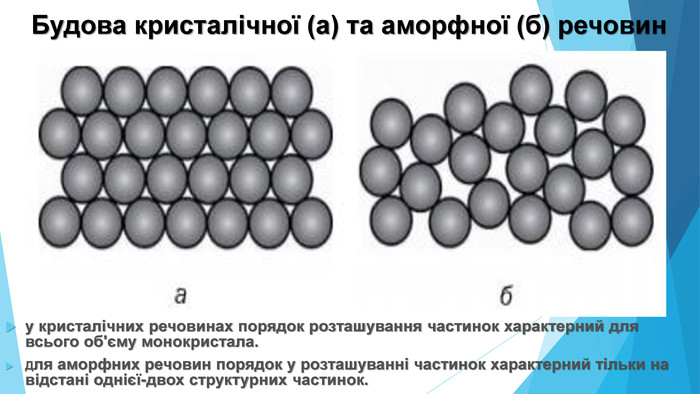
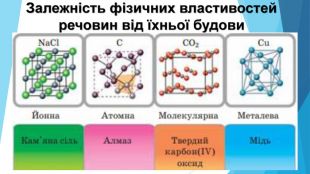
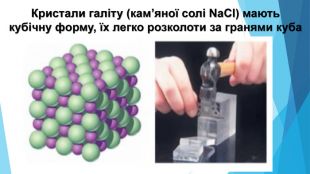
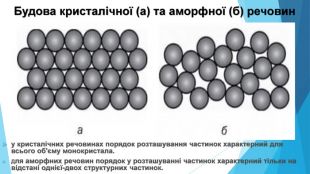
Кристалічні речовини• структурні одиниці розташовані в чіткому порядку — утворюють кристалічні ґратки; • мають певну температуру плавлення; • утворюють кристали певної форми; • у разі руйнування кристалічної речовини кристали розпадаються на окремі шматочки, кожен із яких зберігає хоча б частково форму початкового кристала; • приклади речовин: природні мінерали, кухонна сіль, цукор.
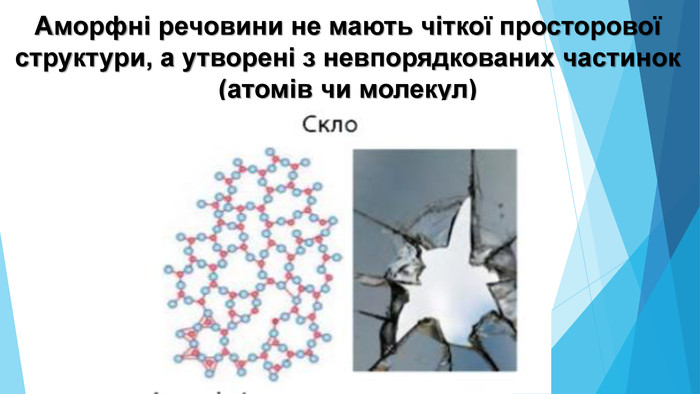
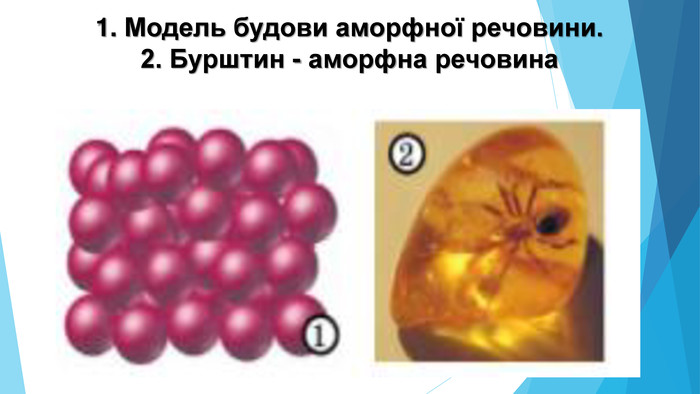
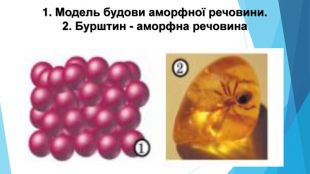
Аморфні речовини• не мають чіткої просторової структури — структурні одиниці розташовані невпорядковано; • плавляться в певному діапазоні температур; • за нагрівання спочатку розм’якшуються; • у разі руйнування утворюються уламки неправильної форми, зазвичай із нерівною поверхнею країв сколу; • приклади речовин: скло, смоли, бурштин, застиглі лаки, клеї, каучук.
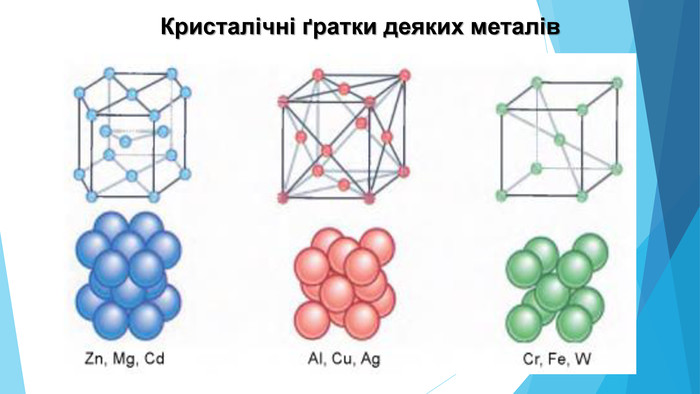
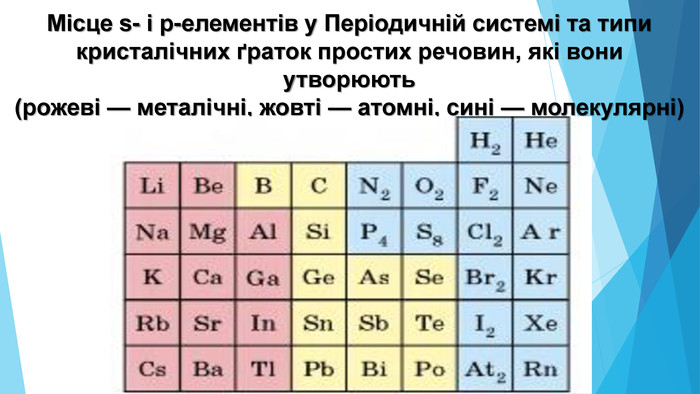
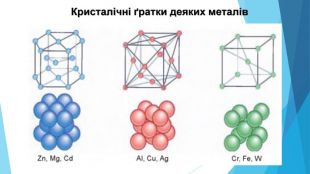
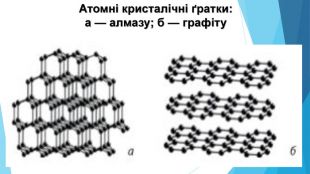
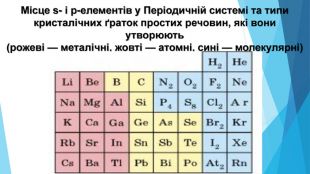
5. Будова простих речовин і місце елементів у Періодичній системіНа початку періодів розташовані металічні елементи, які утворюють прості речовини з металічними кристалічними ґратками. Завершують кожний період неметалічні елементи, які утворюють прості речовини з молекулярними кристалічними ґратками. Елементи, що розташовані в середині періоду (як металічні, так і неметалічні), утворюють прості речовини з атомними кристалічними ґратками.
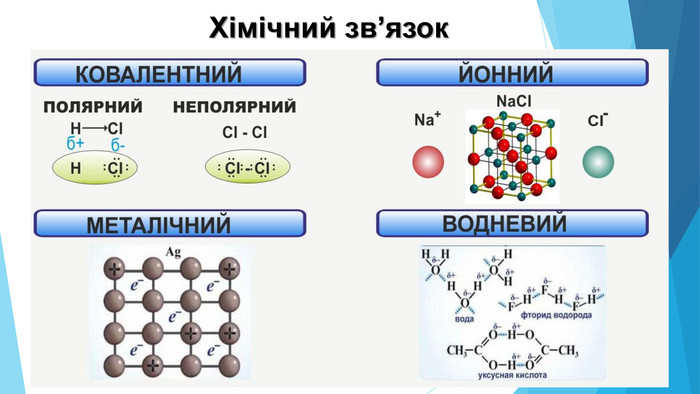
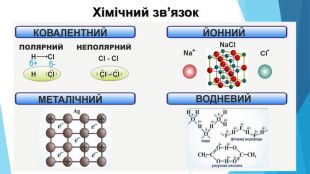
Тест-контроль1. Схарактеризуйте фізичні властивості речовин із кристалічними ґратками: а) металічними; б) йонними; в) молекулярними; г) атомними. 2. Які типи хімічних зв'язків характерні для речовин із кристалічними ґратками: а) атомними; б) йонними; в) молекулярними? 3. Якими хімічними зв'язками утримуються: а) атоми в молекулі; б) молекули в молекулярному кристалі; в) йони в йонному кристалі; г) атоми в атомному кристалі? 4. Схарактеризуйте місце в Періодичній системі s- та p-елементів, прості речовини яких мають кристалічні ґратки: а) металічні; б) атомні; в) молекулярні.5. Поясніть, чому кварц Si02 і вуглекислий газ С02 мають зовсім різні фізичні властивості, незважаючи на подібний склад.6. 3 наведеного переліку випишіть окремо формули речовин із різними кристалічними ґратками у твердому стані: Mg. Br2, Zn, F2, Zn. O, Cl2, Si, Са, KN03, HBr, Cr2(S04)3, Si02, Li20. 7. Порівняйте електронні конфігурації атомів Карбону та Плюмбуму. Чому видалити електрон із зовнішнього рівня Карбону важче, ніж у Плюмбуму? Чому алмаз є неметалом, а свинець — металом? 8. Певна безбарвна речовина добре розчиняється у воді й має високу температуру плавлення. Висловте припущення щодо її кристалічних ґраток. Чи може ця речовина мати запах? 9. Обґрунтуйте, які особливості будови зумовлюють таке застосування наведених речовин: а) мідь — виготовлення електричних дротів; б) золото — фольга для золочення; в) алмаз — розрізання скла. 10. Схарактеризуйте періодичність зміни кристалічних ґраток твердих простих речовин, утворених s- та р-елементами.


про публікацію авторської розробки
Додати розробку


















-

Фертак Наталя Володимирівна
30.09.2025 в 18:45
Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Потапова Галина Іванівна
17.10.2024 в 22:40
Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Товстолес Лариса
05.10.2023 в 23:20
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Пилипчук Галина Володимирівна
18.10.2022 в 20:12
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Морозюк Максим
14.10.2022 в 15:34
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 2 відгука