Презентація по темі: "Залізо. Фізичні та хімічні властивості"


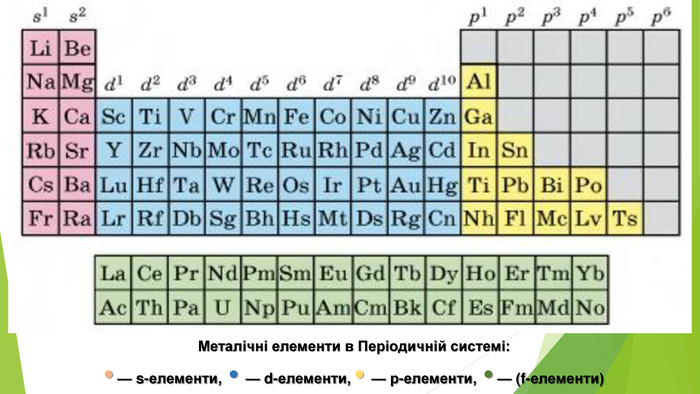
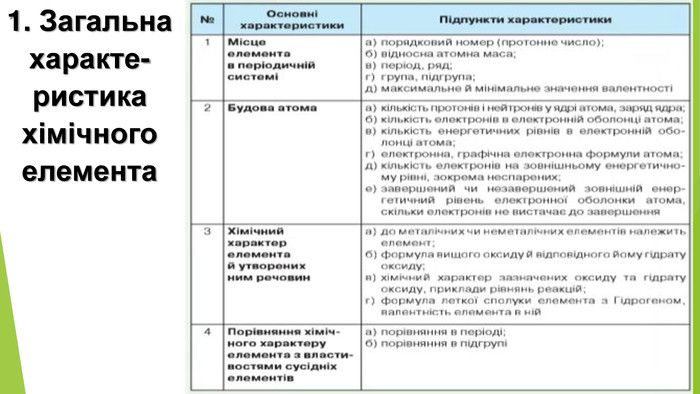







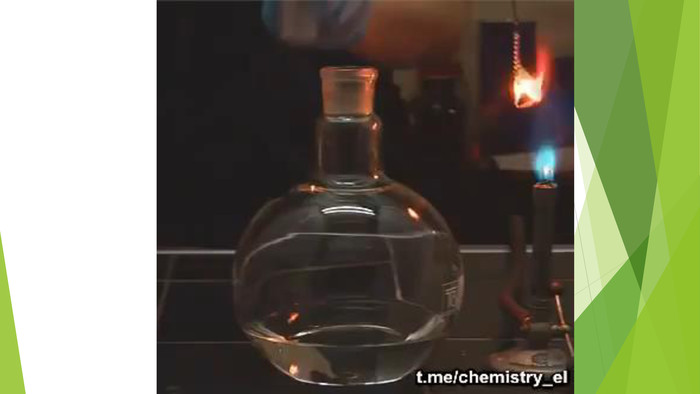




















1. Схарактеризуйте хімічну активність алюмінію. 2. Чим ви поясните, що Алюміній має ступінь окиснення +3, а не, приміром, +2 чи -5? 3. Зважаючи на хімічні властивості алюмінію, сформулюйте поради щодо використання алюмінієвого кухонного посуду. 4. Де в промисловості застосовують відновні властивості алюмінію?5. Схарактеризуйте хімічний елемент Алюміній та фізичні властивості утвореної ним простої речовини.6. Чому не можна тримати луги в алюмінієвій тарі? 7. Користуючись рядом активності металів, розташуйте метали мідь, натрій, алюміній за зростанням хімічної активності.8. Напишіть хімічні рівняння за схемою перетворень:9. Сплав міді й алюмінію масою 15 г обробили надлишком хлоридної кислоти й добули водень об’ємом 13,44 л (н. у.). Обчисліть масові частки металів у сплаві.
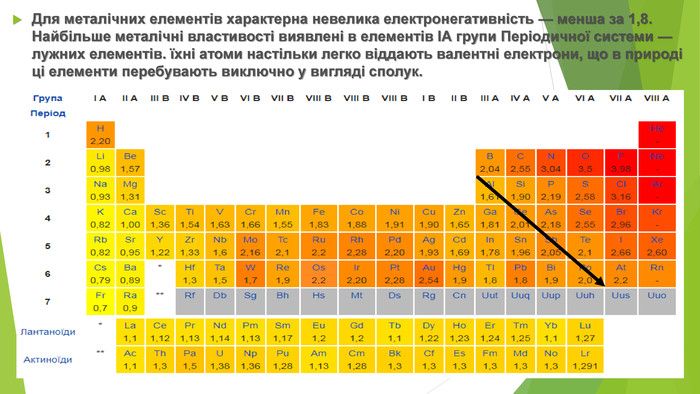
Для металічних елементів характерна невелика електронегативність — менша за 1,8. Найбільше металічні властивості виявлені в елементів ІА групи Періодичної системи — лужних елементів. їхні атоми настільки легко віддають валентні електрони, що в природі ці елементи перебувають виключно у вигляді сполук.
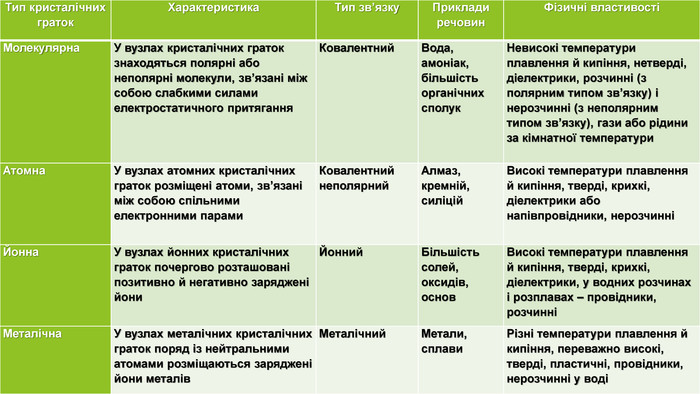
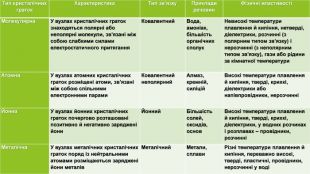
{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}Тип кристалічних граток. Характеристика Тип зв’язку Приклади речовин. Фізичні властивостіМолекулярна У вузлах кристалічних граток знаходяться полярні або неполярні молекули, зв’язані між собою слабкими силами електростатичного притягання Ковалентний Вода, амоніак, більшість органічних сполук. Невисокі температури плавлення й кипіння, нетверді, діелектрики, розчинні (з полярним типом зв’язку) і нерозчинні (з неполярним типом зв’язку), гази або рідини за кімнатної температури Атомна. У вузлах атомних кристалічних граток розміщені атоми, зв’язані між собою спільними електронними парами. Ковалентний неполярний. Алмаз, кремній, силіцій Високі температури плавлення й кипіння, тверді, крихкі, діелектрики або напівпровідники, нерозчинніЙонна У вузлах йонних кристалічних граток почергово розташовані позитивно й негативно заряджені йони. Йонний Більшість солей, оксидів, основ. Високі температури плавлення й кипіння, тверді, крихкі, діелектрики, у водних розчинах і розплавах – провідники, розчинніМеталічна. У вузлах металічних кристалічних граток поряд із нейтральними атомами розміщаються заряджені йони металів. Металічний Метали, сплави. Різні температури плавлення й кипіння, переважно високі, тверді, пластичні, провідники, нерозчинні у воді
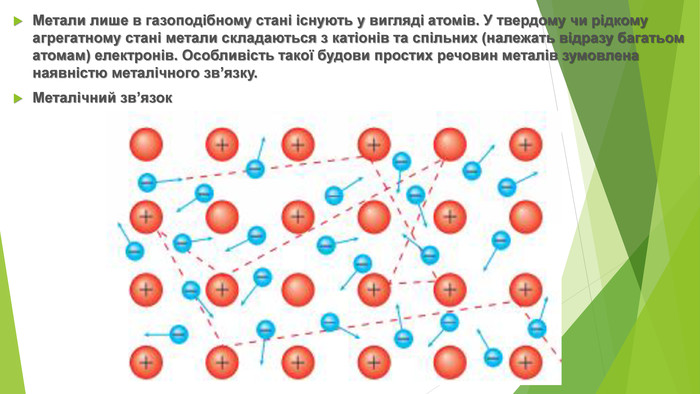
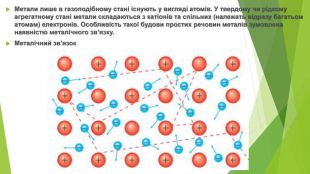
Метали лише в газоподібному стані існують у вигляді атомів. У твердому чи рідкому агрегатному стані метали складаються з катіонів та спільних (належать відразу багатьом атомам) електронів. Особливість такої будови простих речовин металів зумовлена наявністю металічного зв’язку. Металічний зв’язок
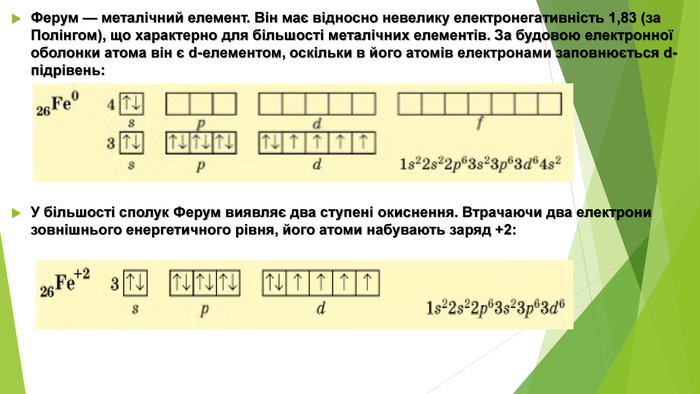
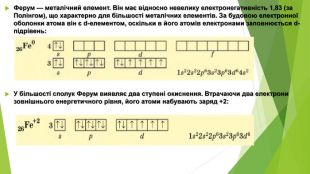
Ферум — металічний елемент. Він має відносно невелику електронегативність 1,83 (за Полінгом), що характерно для більшості металічних елементів. За будовою електронної оболонки атома він є d-елементом, оскільки в його атомів електронами заповнюється d-підрівень: У більшості сполук Ферум виявляє два ступені окиснення. Втрачаючи два електрони зовнішнього енергетичного рівня, його атоми набувають заряд +2:
У такому стані в йонах Fe2+ на Зd-підрівні міститься шість електронів, але більш стабільним є стан, коли Зd-підрівень буде заповнений наполовину. Для цього йону Fe2+ необхідно віддати один електрон. У такий спосіб утворюються йони Fe3+, які мають стабільнішу електронну конфігурацію: Унаслідок цього ступінь окиснення +3 для Феруму стабільніший за +2. Як виняток, Ферум може віддавати шість електронів і виявляти ступінь окиснення +6 . Однак сполуки, у яких містяться Fe+6, трапляються досить рідко. Сполук, у яких ступінь окиснення Феруму +8 , ще не виявлено. Ферум(ІІ) оксид і ферум(ІІ) гідроксид — основні речовини, а ферум(ІІІ) оксид і ферум(ІІІ) гідроксид — амфотерні. Сполуки Феруму в ступені окиснення +3 виявляють окисні властивості.
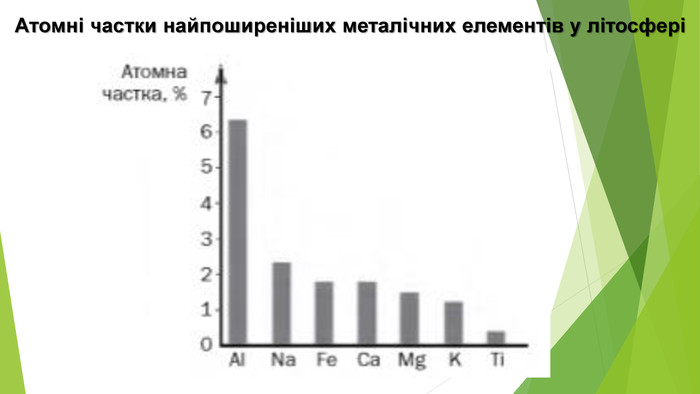
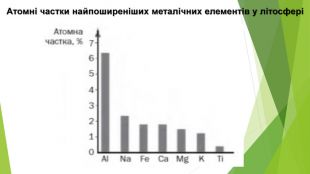
2. Поширеність у природіФерум є одним із найпоширеніших металічних елементів на Землі. У земній корі на атоми Феруму припадає 5 % (за масою) — це друге місце серед металічних елементів (після Алюмінію) та четверте серед усіх елементів. У самородному стані Ферум не трапляється, але у вигляді простої речовини залізо міститься у складі деяких метеоритів, які іноді знаходять на поверхні Землі. Уважають, що саме залізо становить більшу частину ядра Землі та планет земної групи. У природі Ферум трапляється виключно у сполуках, найпоширенішими серед яких є оксиди: ферум(ІІ) оксид Fe. O, ферум(ІІІ) оксид Fe2 О3, а також змішаний оксид Fe3 О4 (Fe. O•Fe2 О3), який називають залізною окалиною. Сполуки тривалентного Феруму мають забарвлення від жовтого до бурого. Саме вони надають жовтуватого кольору піску та бурого забарвлення багатьом ґрунтам. Залізо метеоритного походження. У перекладі з шумерської «залізо» означає «те, що капнуло з неба». Можливо, назва цього металу пояснюється тим, що перше відоме людству залізо було метеоритного походження і дійсно падало з неба.
Також Ферум міститься у складі багатьох різних мінералів у вигляді оксидів, сульфідів та інших сполук. Зазвичай вони розсіяні в земній корі, але трапляються і скупчення мінералів. Такі мінерали, як бурий, магнітний і червоний залізняки, є джерелом залізної руди, з якої добувають залізо. Деякі мінерали Феруму мають красивий вигляд, тому їх використовують як виробне каміння — це сидерит, пірит і халькопірит. В Україні є великі поклади залізної руди — Криворізький, Кременчуцький, Придніпровський залізорудні басейни тощо. Ці запаси оцінюють у майже 30 млрд тонн, чого має вистачити на 180 років промислової розробки. За обсягами виробництва залізної руди Україна посідає сьоме місце серед країн світу. Сполуки Феруму розчинені у воді деяких джерел мінеральних вод. Наявність у воді сполук двовалентного Феруму надає їй так званого «металічного» присмаку. Іноді у водопровідній воді, що тече старими залізними трубами, розчинені сполуки тривалентного Феруму, які надають воді «іржавого» кольору.
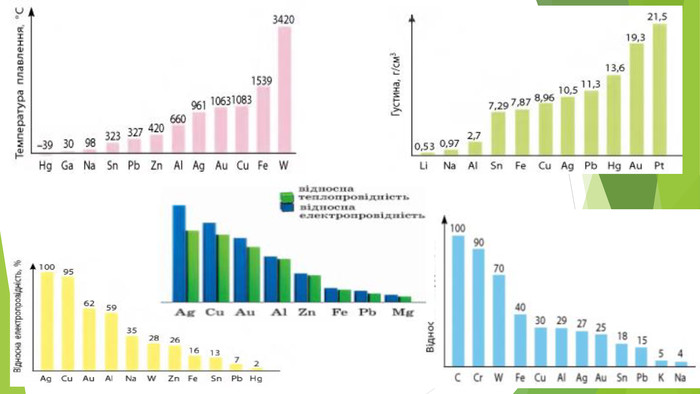
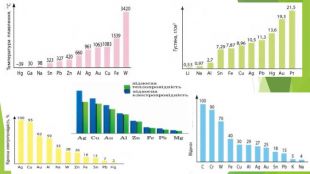
3. Фізичні властивості заліза• Метал сірого кольору з металічним блиском; • добре проводить електричний струм і теплоту; • пластичний, добре піддається куванню, наявність домішок, зокрема вуглецю, підвищує твердість і крихкість заліза; • tпл. = 1540°С, tкип. = 2860°С; • густина 7,87 г/см3; • притягується магнітом (парамагнетик);• Для заліза також характерне явище феромагнетизму — воно зберігає намагніченість після усунення дії зовнішнього магнітного поля. Завдяки цьому із заліза можна виготовляти магніти, а також матеріали для запису інформації.
4. Хімічні властивості заліза. Залізо з високим ступенем чистоти не піддається корозії — іржавінню. В Індії у м. Делі близько 16 століть стоїть монолітна колона заввишки 7,21 м, виготовлена майже із чистого (99,72 %) заліза, і вона практично не піддається іржавінню. Учені до цього часу не дійшли остаточної думки про те, як в ті часи отримали залізо такого ступеня чистоти. Різні домішки збільшують активність заліза в усіх хімічних реакціях. Неіржавіюча колона з чистого заліза (м. Делі, Індія)
Залізо досить активно вступає в хімічні взаємодії, його можна віднести до металів середньої активності. 1. Реакції з неметалами. Залізо активно реагує з неметалами. Із киснем реакція повільно відбувається навіть за звичайних умов. За нагрівання заліза на повітрі його поверхня вкривається залізною окалиною: Реакція заліза з киснем
2. Взаємодія з водою. Залізо реагує з водою: під час пропускання перегрітої водяної пари крізь розпечені залізні ошурки залізо перетворюється на залізну окалину, і виділяється водень:3. Взаємодія з кислотами. За звичайних умов залізо активно реагує з кислотами. Продуктами реакції є солі Феруму в ступені окиснення +2:Із кислотами-окисниками (концентрованими сульфатною та нітратною кислотами) Ферум окиснюється до ступеня окиснення +3. Але холодні кислоти пасивують залізо, реакція відбувається лише за нагрівання:
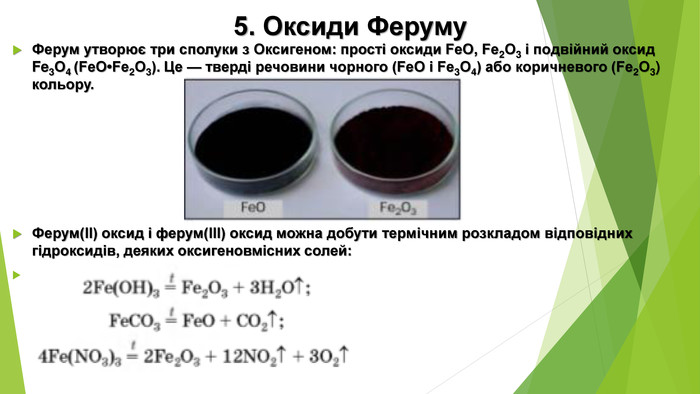
5. Оксиди Феруму Ферум утворює три сполуки з Оксигеном: прості оксиди Fe. O, Fe2 О3 і подвійний оксид Fe3 О4 (Fe. O•Fe2 О3). Це — тверді речовини чорного (Fe. O і Fe3 О4) або коричневого (Fe2 О3) кольору. Ферум(ІІ) оксид і ферум(ІІІ) оксид можна добути термічним розкладом відповідних гідроксидів, деяких оксигеновмісних солей:
6. Гідроксиди Феруму. Гідроксиди Феруму нерозчинні у воді; сполука Fe(OH)2 має білий колір, іноді із зеленкуватим відтінком, a Fe(OH)3 — бурий. Добути чистий ферум(ІІ) гідроксид за реакцією обміну у водному розчині дуже важко; він досить швидко окиснюється розчиненим у воді киснем повітря й перетворюється на ферум(ІІІ) гідроксид:
Цікаво, що…Прості оксиди Феруму різняться за хімічним характером: Fe. O — основний оксид, Fe2 О3 — амфотерний. За хімічним характером гідроксиди Феруму подібні до відповідних оксидів: сполука Fe(OH)2 є основою, a Fe(OH)3 — амфотерним гідроксидом, який, однак, майже не реагує з розчином лугу за звичайних умов.
7. Солі Феруму. Елемент Ферум утворює багато солей. Солі Феруму(ІІ) містять катіони Fe2+, а в солях Феруму(ІІІ) цей металічний елемент може перебувати у формі катіонів Fe3+ (Fe. F3, Fe2(SО4)3) або бути складником аніонів кислотних залишків (Na. Fe. O2, K3 Fe. О3). Розчинні солі Феруму при випарюванні води з їх розчинів виділяються у вигляді кристалогідратів — Fe. SО4 • 7 Н20, Fe. Cl3 • 6 Н20 тощо. Більшість солей Феруму(ІІ) зеленкувато-блакитні, а солі Феруму(ІІІ) мають різне забарвлення; зокрема, сполука Fe. Cl3 • 6 Н2 О — коричневий, Fe2(SО4)3 • 9 Н20 — білий, Fe(NО3)3 • 9 Н2 О — блідо-бузковий. Солі Феруму зазнають гідролізу; їх розчини мають кисле середовище:
6. Застосування алюмінію• У великих кількостях алюміній використовують у металургії для одержання інших менш активних металів методом алюмотермії. • Алюміній є цінним конструкційним матеріалом. Він відносно легкий (густина алюмінію набагато менша за густину сталі), але досить міцний. Тому з алюмінію виготовляють легкі й довговічні будівельні конструкції • Багато алюмінію потребує авіаційна промисловість. Дюралюмінієм обшивають корпуси літаків. • Пилоподібний алюміній та деякі його сполуки використовують як тверде ракетне пальне. • Алюміній легко піддається штамповці, він стійкий до корозії, а його сполуки нетоксичні. Завдяки цьому з алюмінію виготовляють столові прибори, посуд, бляшанки, кухонні гаджети. • Через свою високу відбивну здатність та легкість напилення алюміній є ідеальним матеріалом для виготовлення дзеркал. • Суміш алюмінію з ферум(ІІІ) оксидом — терміт — використовують для зварювання залізничних рейок та труб. Застосування алюмінію:а — у будівництві; б — в авіаційній промисловості; в — для виготовлення харчових ємностей
8. Застосування заліза, його сплавів та сполук Феруму. На сплави заліза припадає 95% світового металургійного виробництва. Найпоширенішими є сплави заліза з вуглецем — сталь (w(С) < 2,1% ) і чавун (w (С) > 2,1%). Сьогодні сталь є головним конструкційним матеріалом. Зі сталі виготовляють каркаси будинків, труби, корпуси транспортних засобів тощо. Для конкретного застосування використовують певні марки сталі, створені з урахуванням особливостей майбутніх виробів. Наприклад, додаванням до заліза близько 1 % вуглецю одержують сталь, що має високу твердість, її використовують для виготовлення різальних інструментів. Додаванням хрому й нікелю одержують стійку до корозії сталь (нержавіюча сталь). Зі сплаву заліза з манганом виплавляють рейки для залізниці. Чавун значно твердіший і крихкіший за сталь, він не піддається куванню, однак вироби з нього витримують великі механічні навантаження. Раніше з чавуну виплавляли пушки, ядра та посуд. Сьогодні виготовляють також станини для верстатів, ковані ґратки, вуличні лави й ліхтарі та інші вироби, для яких більш важлива міцність, ніж пластичність. Але такі речі «бояться» ударів: від сильного удару чавун розбивається. Магнетит завдяки його феромагнітним властивостям використовують для створення носіїв інформації: магнітних плівок, жорстких магнітних дисків тощо. Через феромагнітну властивість та чорний колір із магнетиту виготовляють тонер для чорно-білих лазерних принтерів. Залізний купорос (Fe. SО4•7 H2 О) разом із мідним купоросом застосовують у садівництві й будівництві для боротьби зі шкідливими грибками. Хлориди або сульфати Феруму(ІІ) і Феруму(ІІІ) використовують для очищення природних вод на станціях водопідготовки.
9. Біологічне значення Феруму. Ферум — важливий мікроелемент. В організмі дорослої людини 25 % Феруму міститься у складі деяких вітамінів і білків, а 75 % — у складі гемоглобіну. Нестача Феруму призводить до анемії — недокрів’я. Добова потреба Феруму становить: 4-18 мг — у дітей, 10 мг — у чоловіків і 18 мг — у жінок. В організм людини Ферум надходить з їжею, найбільш багаті на нього печінка, м’ясо, яйця, бобові, хліб, буряк тощо.
У надмірній кількості Ферум може пригнічувати функціонування антиоксидантної системи організму, а також спричинити алергічні реакції та захворювання печінки й крові. Більша ймовірність уживання надлишкового Феруму є в мешканців будинків із центральним водогоном через можливість потрапляння його у воду з іржавих труб. Ферум є істотно важливим для всіх форм життя металічним елементом. Його загальна маса в організмі людини становить 4,2 г, уміст у крові - 447 мг/л, масова частка в кістковій тканині - (0,03-3,8) • 10-2 %, у м’язовій - 1,8 • 10-2 %. Близько 20 % Феруму в організмі депоновано в печінці, селезінці, кістковому мозку, це його «фізіологічний резерв». Ферум є складником гемоглобіну крові, він потрібен для «зчеплення» його з киснем. Також цей елемент є компонентом м’язового міоглобіну, стимулює клітинне дихання.
10. Виведення плями від іржі на тканиніДля того щоб вивести пляму від іржі на тканині, можна використати кислоту, яка реагує з ферум(ІІІ) гідроксидом з утворенням розчинної солі. Проте ця кислота не повинна руйнувати волокна тканини й діяти на барвник, якщо тканина кольорова. Ці вимоги задовольняють органічні кислоти — лимонна, оцтова, щавлева, винна. Спосіб 1. Забруднену ділянку білої тканини змочують концентрованим розчином лимонної кислоти, наносять на неї тонкий шар дрібної кухонної солі і залишають на кілька годин (іноді — на добу). Після виведення плями тканину промивають теплою водою. Замість розчину лимонної кислоти можна використати сік лимона. Спосіб 2. Розбавлений розчин оцтової кислоти (2 столові ложки оцту на склянку води) нагрівають в емальованій посудині до 80— 90 °С і занурюють у нього на 3-5 хв. забруднену ділянку тканини. Якщо пляма іржі не зникає, процедуру повторюють. Потім тканину промивають теплою водою, в яку додають нашатирний спирт (одну столову ложку на 2 л води).
1. Схарактеризуйте електронну будову атома та поширеність Феруму в природі. 2. Порівняйте будову електронної оболонки атомів Феруму, йонів Fe2+ та Fe3+. 3. Схарактеризуйте хімічні й фізичні властивості та застосування заліза. Нa яких властивостях заліза ґрунтується його застосування? 4. Чи трапляється в природі самородне залізо? Поясніть чому. 5. Схарактеризуйте біологічне значення Феруму. Що загрожує людині в разі нестачі або надлишку Феруму в організмі?6. Який зі ступенів окиснення Феруму є найстабільнішим? Поясніть чому. 7. Під час взаємодії заліза з якими речовинами утворюються сполуки Феруму(ІІ), а з якими — Феруму(ІІІ)?8. Щоб виявити домішки заліза в платиновому посуді, наприклад у тиглі, його нагрівають до червоного розжарення. Поверхня металу покривається червоним нальотом. Із чим це пов'язано? Як видалити цей наліт, не пошкодивши виріб? 9. Випишіть із тексту параграфа рівняння реакцій, які характеризують окисно-відновні властивості заліза, і складіть для них електронний баланс.10. Ферумовмісні мінерали використовують як сировину для добування заліза. Обчисліть масову частку Феруму у відомих вам ферумовмісних мінералах. Який із цих мінералів вигідніше використовувати для добування заліза?
11. Обчисліть об'єм карбон(ІІ) оксиду (н. у.), необхідний для повного відновлення ферум(ІІІ) оксиду масою 320 г. 12. Обчисліть масу магнетиту, що містить 10 % домішок, який необхідний для добування заліза масою 3 тонни.13. Обчисліть масу заліза, яка необхідна для одержання нітроген(ІІ) оксиду масою 224 мл взаємодією заліза з гарячою нітратною кислотою. 14. Змішали залізну окалину Fe3 О4 масою 34,8 г із порошком алюмінію масою 12,8 г. Суміш нагріли. Обчисліть масу утвореного заліза.15. Запишіть формули мінералів Fe3 Al2(Si. О4)3 і Ca3 Fe2(Si. О4)3 (їх загальна назва — гранати) за допомогою формул відповідних оксидів. 16. Складіть електронні формули катіонів Феруму та зобразіть їх графічні варіанти. 17. Допишіть схеми реакцій і складіть хімічні рівняння:
18. Вставте замість крапок формули речовин і перетворіть схеми реакцій на хімічні рівняння:19. Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:20. Ферум(ІІ, III) оксид реагує з кислотами подібно до суміші простих оксидів Феруму. Складіть рівняння реакцій сполуки Fe3 О4 з хлоридною і розбавленою сульфатною кислотами. 21. Виведіть формулу оксиду Феруму, в якому масова частка металічного елемента становить 70 %. 22. Яку масу ферум(ІІІ) нітрату потрібно взяти для добування 8 г ферум(ІІІ) оксиду? 23. Визначте кількість молекул води у формулі солі Fe. CI2 • n. Н2 О, якщо масова частка води у сполуці становить 36,2 %.
24. Який об’єм водню виділиться за нормальних умов, якщо до 1,12 г заліза додати 18 г хлоридної кислоти з масовою часткою НСІ 10 %? 25. У розчин купрум(ІІ) сульфату занурили залізну пластинку масою 28 г. Через деякий час маса пластинки збільшилась до 30 г. Обчисліть масу міді, яка виділилась на пластинці. Зважте на те, що утворюваний метал із пластинки не осипається.26. Установіть відповідність між електронними формулами атомів і назвами хімічних елементів.


про публікацію авторської розробки
Додати розробку































-

Чигура Oксана Ярославівна
14.02.2024 в 13:18
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Переверзева Інна Євгенівна
16.02.2023 в 21:00
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Товстолес Лариса
08.02.2023 в 21:14
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Обертінська Вікторія
10.04.2022 в 18:29
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Вербинська Олена Степанівна
26.01.2022 в 09:03
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Буценко Надія Олександрівна
25.02.2021 в 07:36
Дуже корисна робота, цікавий ілюстративний матеріал, повністю може бути використана. Успіхів авторці !
Загальна:
4.7
Структурованість
4.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 3 відгука