Презентація "Поняття про жорсткість води та способи її усунення"
Про матеріал
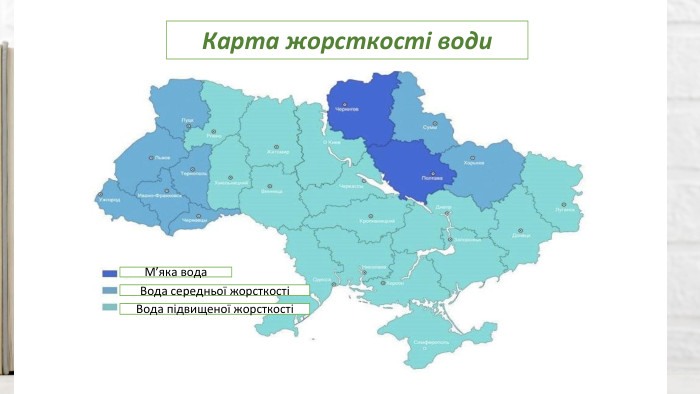
Презентація на тему "Жорсткість води та способи її усунення " 11 клас. Метою уроку є ознайомити учнів з поняттям жорсткість води, її видами (постійною, тимчасовою), методами їх усунення (зменшення); закріпити вміння складати рівняння хімічних реакцій; розширити знання учнів про природну воду, сполуки кальцію та магнію. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку