Презентація "Практична робота №2: "Розв’язування експериментальних задач у віртуальній лабораторії"
Про матеріал
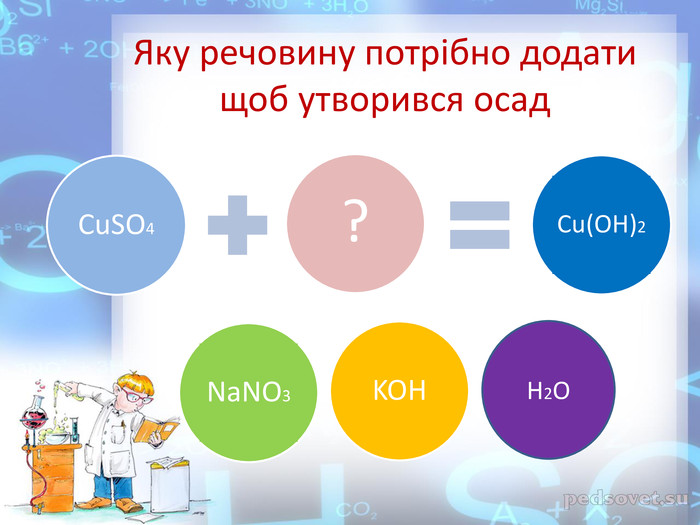
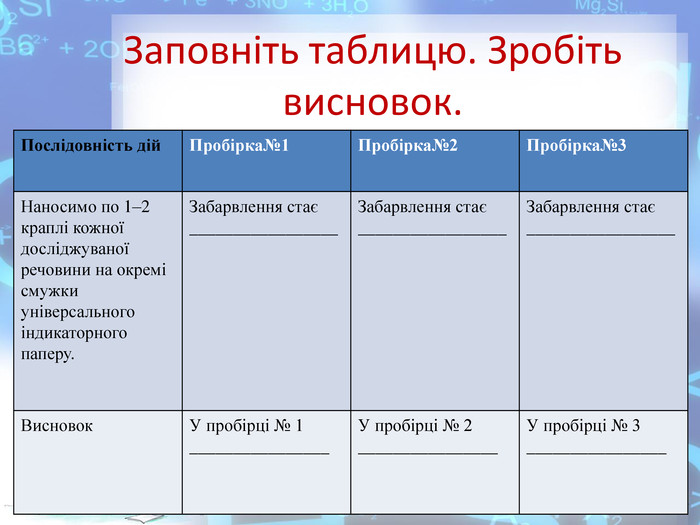
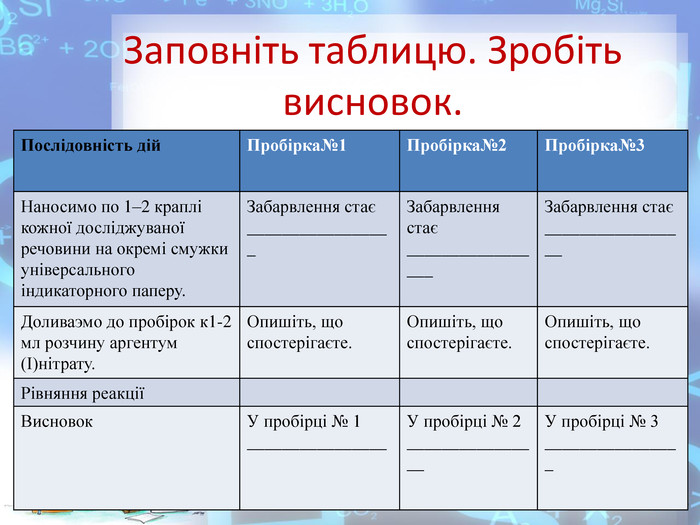
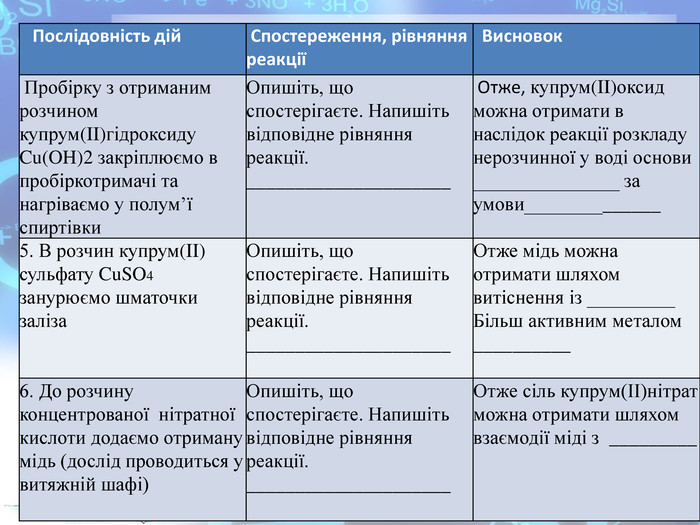
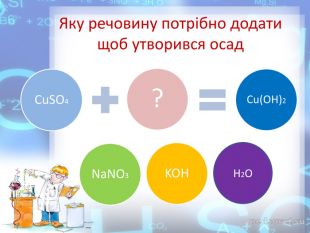
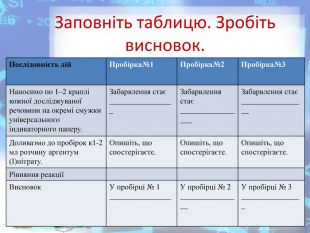
Практична робота №2 "Розв’язування експериментальних задач у віртуальній лабораторії" розроблена у вигляді презентації, має чітку інструкцію, роз'яснення та послідовність виконання експериментальних завдань які супроводжуються унаочненням та посиланнями на відеодосліди. Використання практичної роботи може відбуватись як самостійно учнями, так і в умовах взаємодії з учителем через систему дистанційного навчання. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку