Презентація " Процеси окиснення. Умови виникнення та припинення горіння"
Про матеріал
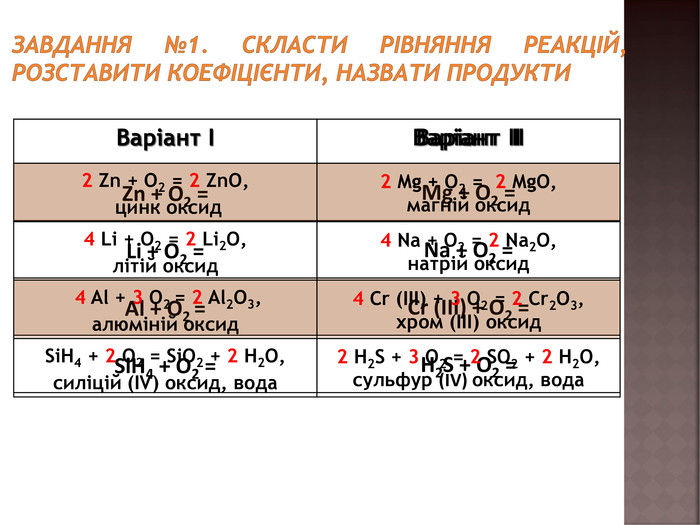
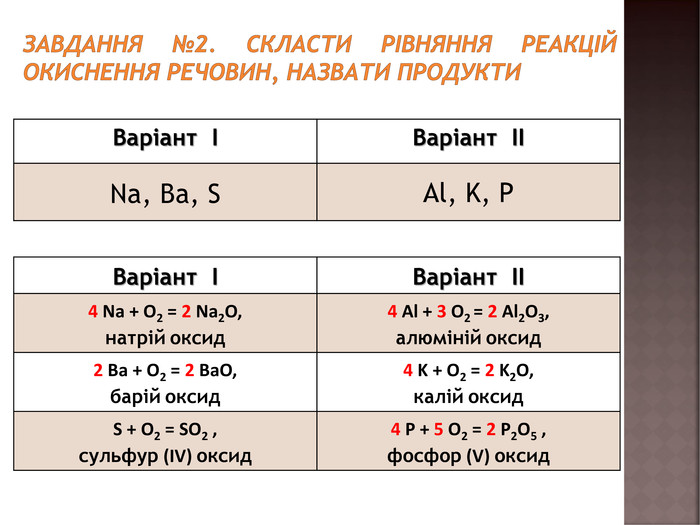
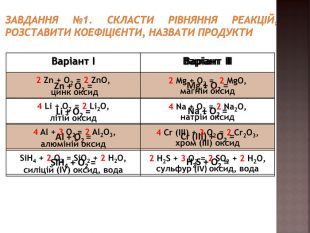
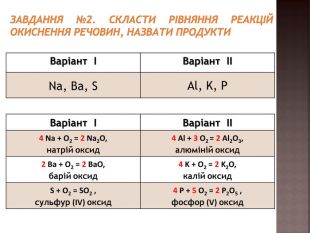
Повторення навичок складання рівнянь взаємодії речовин з киснем;
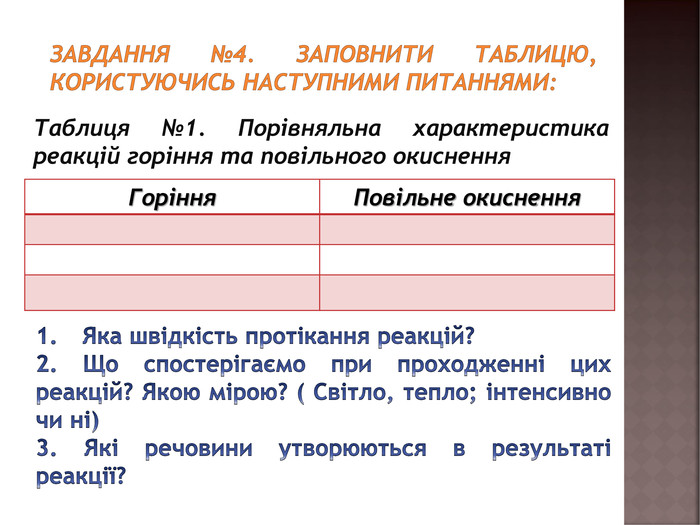
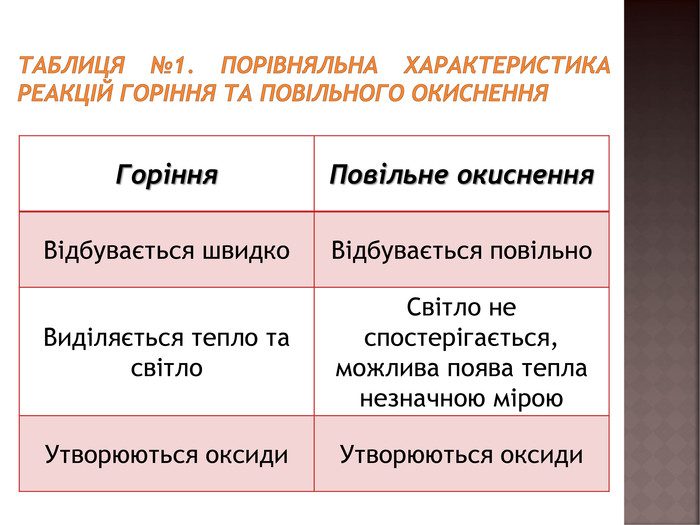
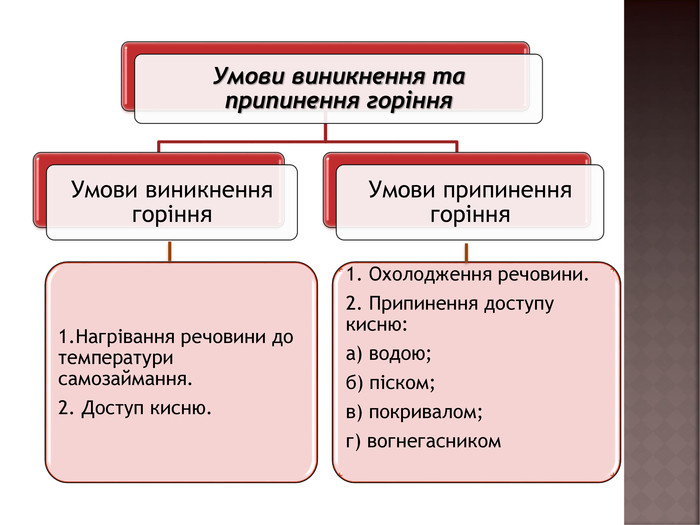
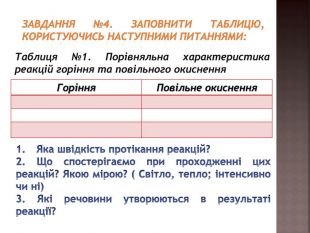
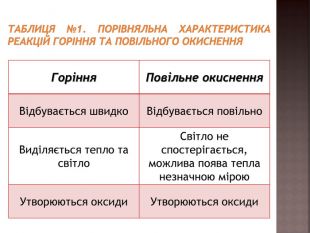
засвоєння нового матеріалу: реакція горіння, порівняльна характеристика реакцій горіння та повільного окиснення; умови виникнення та припинення горіння Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку