Презентація "Розв'язування розрахункових задач"
Про матеріал
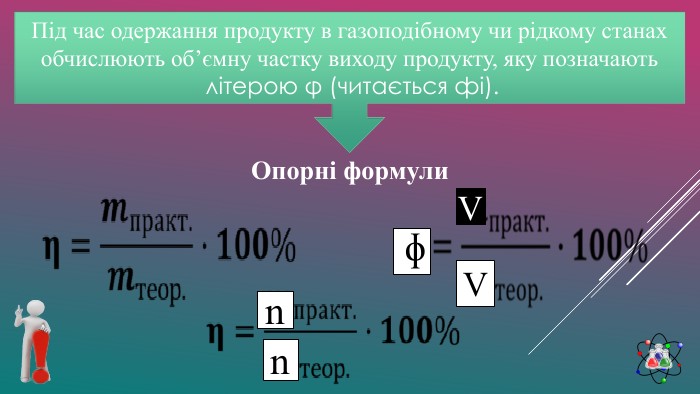
Презентація містить задачі з розв'язками та задачі для самостійного розв'язання. Матеріал розраховано для повторення обчислень маси, об'єму або кількості речовини, якщо один із реагентів дано в надлишку, а також розрахунків з використанням поняття "відносний вихід продукту реакції від теоретично можливого". Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Дякую!!!!


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку