Урок "Хімічний зв'язок"
Тема урока: Хімічний зв’язок (ковалентний, йонний, металічний, водневий). Донорно-акцепторний механізм утворення ковалентного зв’язку.
Клас: одинадцятий
Мета:
- Навчальна – поглибити знання учнів про хімічний зв’язок
- Розвиваюча – розвити у дітей навички логічного мислення, навички аналізу отриманої інформації (робити висновки та виділяти найважливіші моменти).
- Виховна – виховувати у дітей взаємоповагу одне до одного та повагу до вчителя; розвити навички концентрації на матеріалі;
Тип уроку:
Форми і методи навчання: пояснювально-ілюстративні: розповідь, взаємодія із класом (бесіда), робота з опорною схемою; практичні: робота біля дошки, виконання вправ.
Обладнання: презентація, періодична система хімічних елементів Д.І. Менделєєва, опорна таблиця «Типи хімічних зв’язків», опорні таблиці та схеми.
Література:
- для учнів:
1. Григорович О.В. Хімія: підручник для 11 класу загальноосвіт. навч. закладів. — Х.: Вид-во «Ранок», 2019. — 229 с.: іл.
- для вчителя:
- Березан О.В. Збірник задач з хімії: для учнів серед. загально-освіт. навч. закл.– Т.: Підручники і посібники, 2003.– 319 с.
- Григор’єва В.В., Самійленко В.М., Сич А.М. Загальна хімія. – К.: Освіта 1991. – 380 с.
СТРУКТУРА УРОКУ:
- Організаційний етап……………………………………………………..2 хв
- Актуалізація опорних знань…………………………………………….6 хв
- Вивчення нового матеріалу…………………………………………... 21 хв
- Хімічний зв’язок. Умови виникнення……… ……………………..3 хв
- Ковалентний зв’язок. Полярний та неполярний……………………5 хв
- Донорно-акцепторний механізм утворення ковалентного зв’язку..4 хв
- Іонний зв’язок………………………………………………………...3 хв
- Металічний зв’язок…………………………………………………..3 хв
- Водневий зв’язок……………………………………………………..3 хв
- Вправи……………………………………………………………………8 хв
- Закріплення знань………………………………………………………..5 хв
- Підбиття підсумків уроку……………………………………………….2 хв
- Домашнє завдання………………………………………………….……1 хв
- Організаційний етап
- Привітання.
- Записати відсутніх.
- Ознайомити з темою уроку; якщо потрібно розвісити схеми і т.п.
- Актуалізація опорних знань
Перш ніж розпочинати нову тему, давайте згадаємо основні поняття, які будуть потрібні нам будуть на уроці.
- Що таке електронегативність? (Здатність атомів елемента в хімічних сполуках відтягувати до себе електрони, що беруть участь в утворенні хімічних зв’язків.)
- Як називається позитивно заряджений іон? (Катіон)
- Я називається негативно заряджений іон? (Аніон)
- Робота з періодичною системою хімічних елементів Д.І. Менделєєва:
- Як змінюється електронегативність у: групах (зверху вниз зменшується), періодах (зліва направо збільшується)?
- Як змінюються металічні властивості у групах? (зверху вниз посилюються);
- Як змінюються неметалічні властивості у періодах? (зліва направо посилюються).
- У класі 8 ви поверхнево вивчали 4 типи хімічного зв’язку. Давайте спробуємо їх пригадати:….(ковалентний, іонний, металічний та водневий). Чи зможе [учень А] пригадати два типи ковалентного зв’язку? (полярний та неполярний).
Тож коротко повторимо про кожний з цих зв’язків:
- Ковалентний полярний зв’язок виникає між…….(атомами з близькою електронегативністю);
- Ковалентний неполярний зв’язок виникає між…… (однаковими атомами);
- Іониий зв’язок виникає внаслідок взаємодії…(протилежно заряджених іонів);
- Металічний зв’язок утворюють атоми…(металів);
- З якими сполуками найчастіше Гідроген утворює водневий зв’язок? (Флуор, Оксиген, Нітроген).
- Вивчення нового матеріалу
Тепер перейдемо безпосередньо до теми нашого уроку. Перед уроком я вам роздала пусту таблицю «Типи хімічних зв’язків», протягом уроку по мірі того, як ми будемо просуватися, прошу вас заповнювати цю таблицю. Вона буде в нагоді вам в наступних темах, наприклад, кристалічні гратки.
- Хімічний зв’язок. Умови виникнення.
Типи хімічних зв’язків
|
Частинки, що з’єднуюють |
Частинки, що утворюються |
Приклади речовин |
||
|
Йонний |
|
|
|
|
|
Кова- лент- ний |
Полярний |
|
|
|
|
Неполярний |
|
|
|
|
|
Металічний |
|
|
|
|
|
Водневий (міжмолекулярний) |
|
|
|
|
(Примітка: розмістити пусту таблицю на дошці під час презентації. Після уроку запропонувати її заповнити на оцінку за бажанням.)
Давайте розглянемо основні причини утворення хімічного зв'язку:
1. Нестійкість атомів з незавершеним зовнішнім рівнем і прагнення до його заповнення. Атоми різних елементів, взаємодіючи між собою, утворюють велику кількість простих і складних речовин. В основі теорії хімічного зв’язку лежать поняття про електронну взаємодію. Нам відомо, що атоми благородних газів за звичайних умов не взаємодіють з іншими атомами, бо мають завершений зовнішній енергетичний рівень (двоелектронний у Гелію і восьмиелектронний у решти інертних елементів). Всі інші елементи мають незавершені зовнішні електронні шари, тому атоми цих елементів вступають у взаємодію між собою. Під час взаємодії атомів з незавершеними зовнішніми електронними шарами перебудовуються їх електронні оболонки: неспарені електрони різних атомів утворюють електронні пари, які є спільними для двох чи більшої кількості атомів, або зміщуються до одного атома. Більш детально розглянемо на прикладах далі.
2. Прагнення до мінімуму енергії. Молекула може утворитися тільки тоді, коли при взаємодії атомів їхня загальна енергія зменшується. Інакше кажучи, утворення хімічного зв'язку завжди супроводжується виділенням енергії, яку називають енергією хімічного зв'язку.
- Ковалентний зв’язок. Полярний та неполярний.
Що ж, з поняттям хімічний зв’язок ми розібралися. Тепер детальніше про кожний тип. Почнемо з улюбленого типу багатьох – ковалентного неполярного.
Розглянемо, для прикладу, утворення молекули водню. Згадаємо, що атом Гідрогену складається з…чого? [учень Г] (ядра із зарядом +1 і одного електрона). Для завершення першого енергетичного рівня атому не вистачає одного електрона. Якщо два атоми Гідрогену знаходяться далеко один від одного, то вони не взаємодіють. Коли атоми зближуються між ними виникають сили притягання (ядро одного атома до електрона другого і навпаки) і сили відштовхування (між обома ядрами і обома електронами). Атоми зближуються до певної відстані, поки сила взаємодії не буде рівна нулю, тобто сила притягання врівноважується силою відштовхування. При достатньому зближенні атомів хмари обох атомів перекриваються і між ядрами утворюється згусток негативного заряду. Обидва електрони, кожний з яких раніше належав одному атому, спаровуються і, утворивши одну електронну хмару, стають тепер спільними для обох атомів. Молекула водню — більш стійке утворення, ніж поодинокі атоми. Схематично утворення молекули водню можна зобразити так:

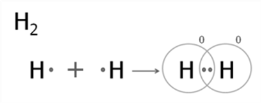
Із схеми видно, що утворення хімічного зв’язку можливе тоді, коли спаровуються два електрони з антипаралельними спінами. Якщо спіни електронів в обох атомах мають однаковий напрямок, електрони відштовхуються, і молекула з них утворитися не може. При утворенні хімічного зв’язку в ролі валентних електронів виступають неспарені електрони в незбуджених або незбуджених атомах.
Такий механізм називається обмінний – він передбачає усуспільнення неспарених електронів двох атомів. Він найбільше характерний для ковалентного неполярного типу зв’язку.
Чи можливий такий механізм для ковалентного полярного типу? Звісно, але цей тип зв’язку як відомо утворюють різні елементи з різною електронегативністю. Коли утворюється спільна електронна пара й негативний заряд, вони дещо зміщені до одного з атомних ядер – більш електронегативного. Що більша різниця електронегативностей в атомів елементів, які зв’язуються, то сильніше відбувається зміщення електронної густини до більш електронегативного елемента.
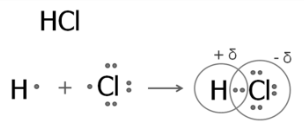
- Як ви гадаєте в ряду сполук: HI, HBr, HCl, HF полярність молекул зростає, чи ні? Якщо так, спробуйте пояснити чому саме?(полярність молекул зростає, бо зростає різниця електронегативностей атома галогену та Гідрогену.)
- Донорно-акцепторний механізм утворення ковалентного зв’язка.
Ми вияснили, що в ковалентному типі хімічного зв’язку є обмінний механізм реакції. Але треба виділити ще один механізм – донорно-акцепторний, де ковалентний зв’язок утворюється за рахунок неподіленої електронної пари одного атома і вільної орбіталі другого атома. Як видно, такий механізм притаманний більше ковалентному полярному типу зв’язка.
Спершу я нагадаю вам про поняття донор та акцептор:
Донором, називають атом (іон), який надає свою неподілену електронну пару для утворення хімічного зв’язку.
Акцептор – це атом (іон), який приймає на свою вільну (вакантну) орбіталь неподілену електронну пару другого атома (іона).
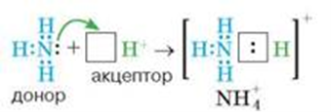
Я пропоную розглянути донорно-акцепторний механізм на прикладі утворення йона амонію, де три зв’язки у молекулі між атомом Нітрогену й атомами Гідрогену утворюються за обмінним механізмом, а один – за донорно-акцепторним.
У молекулі амоніаку атом Нітрогену має чотири електронні пари: одна належить лише йому і три — спільні з атомами Гідрогену:
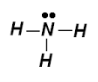
Ця неподілена електронна пара може утворити зв'язок з йоном Гідрогену [H+] (на орбіталях якого відсутні електрони):
- Іонний зв’язок.
Наступний тип хімічного зв’язку – іонний. Що про нього можна сказати?
- При умові, що різниця електронегативностей пари атомів, що утворюють зв’язок, буде більше, або дорівнювати (≥) 1.7, за Полінгом, між ними утвориться іонний зв’язок.
- Окремі йонні молекули можуть існувати лише за дуже високої температури (у газоподібному стані). За звичайних умов такі сполуки – тверді кристалічні речовини.
- Зазвичай такий тип зв’язку утворюється між металічним та неметалічним елементом.
- Як відомо, катіони і аніони беруть участь у цьому зв’язку, і тим сильніше вони притягуються один до одного, чим більший заряд кожної частинки і чим менша відстань між ними.
|
Типи іонів |
|
|
Катіони |
Аніони |
|
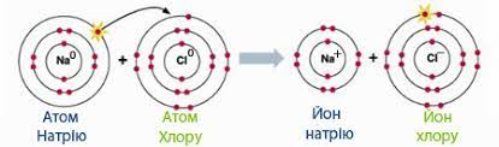
Позитивно заряджені іони. Утворюються внаслідок віддачі електронів Na0 – 1e- → Na+ |
Негативно заряджений іон. Утворююється внаслідок прийняття електронів Cl0 + 1e- → Cl- |
На слайді (дошці) ви можете бачити схему утворення іонного зв’язку на прикладі NaCl: Натрій зі свого зовнішнього рівня віддає один електрон атому Хлору. Так, атом Хлора стає негативно зарядженим, повністю заповнюючи свій зовнішній рівень.
- Металічний зв’язок.
Переходимо до металічного типу хімічного зв’язку.
Як ми повторювали на початку уроку, утворюють цей тип зв’язку – метали. Як відомо, атоми металів відносно легко віддають валентні електрони, внаслідок чого утворюються позитивно заряджені йони. Під час утворення простих речовин – металів, їхніх сплавів – валентні електрони віддаляються від атомів, утворюються йони. Електрони стають спільними і переміщуються по всьому об’єму кристала. Між упорядковано розташованими йонами металічного елемента і відносно вільними валентними електронами виникає електростатичний зв’язок, який і називають металічним.
Вільне переміщення електронного газу зумовлює високу електропровідність та інші властивості. На відміну від йонного та ковалентного хімічних зв’язків, металічний зв’язок не характерний для окремих частинок, а є властивістю їхніх агрегатів у твердому і рідкому стані.
- Водневий зв’язок.
Останній тип хімічного зв’язку - водневий
Низка сполук з полярним ковалентним зв’язком, які містять Гідроген і елемент з високою електронегативністю (найчастіше Оксиген, Флуор, Нітроген), утворюють так званий водневий зв’язок.
Це різновид невалентного міжмолекулярного зв’язку, який виникає між атомами Гідрогену однієї молекули (диполя) з поляризованим атомом (що має велику електронегативність: F, N, O) другої молекули внаслідок набуття ними протилежних часткових електричних зарядів.
Водневий зв'язок впливає на фізичні властивості речовин – підвищуються температури плавлення й кипіння, зменшується густина. Це пов’язано з тим, що потрібна додаткова енергія для розриву водневого зв’язку.
Водневі зв’язки можуть виникати між однаковими або різними молекулами неорганічних (HF, H2O, NH3) та органічних (спиртів, кислот та їх водних розчинів) речовин:

Водневий зв’язок частіше за все показують трьома точками.
- Вправи
- З наведених на дошці (слайді презентації) вибрати у 2 колонки сполуки з ковалентним полярним(КП) та ковалентним неполярним(КН) зв’язком.
Сполуки: HCl, NH3, CCl4, H2, F2, CO, CH4, Br2, H2S, N2, O2
|
КП ( ковалентний полярний) |
КН (ковалентний неполярний) |
|
HCl, NH3, CCl4, CO, CH4, H2S |
H2, F2, Br2, N2, O2 |
- Намалювати за допомогою електронних формул утворення сполук:
H2S O2
![]()
![]()
- Закріплення знань
Сьогодні на уроці ми поглиблено розглянули 4 типи хімічного зв’язку. Зараз я прошу вас до заповнювати вашу таблицю і ми разом її обговоримо. (хвилина на заповнення).
(приблизний вигляд таблиці, для перевірки. Примітка: буде добре, якщо діти заповнять її на свій розсуд і деякі комірки не співпадають слово у слово).
|
Тип зв’язку |
Частинки, що з’єднуюють |
Частинки, що утворюються |
Приклади речовин |
|
|
Йонний |
Атоми елементів, зі значно відмінними електронегативностями (більше 2) |
Позитивно та негативно заряджені йони |
Тверді кристалічні речовини: NaCl, KBr, MgCl2 |
|
|
Кова- лент- ниіій |
Полярний |
Атоми елементів близькі за електронегативністю |
Молекули |
Рідкі та газоподібні речовини: HCl, H2O, CO2 |
|
Неполярний |
Атоми одного і того ж елементу |
Молекули |
Газоподібні, тверді, не так часто рідкі речовини: F2, Cl2, алмаз, графіт |
|
|
Металічний |
Атоми металічних елементів |
Вільні електрони, атоми, йони |
Метали та їх сплави |
|
|
Водневий (міжмолекулярний) |
Молекули-диполі, в склад яких входять ОН- групи |
Асоціація диполів |
Вода, спирти |
|
Викликати всіх учнів присутніх на уроці для закріплення матеріалу.
Підбиття підсумків уроку
- Виставити оцінки активним учням, менш активним дати бонуси на наступний урок;
- На додаткову оцінку запропонувати творче завдання: зробити макет будь-якої молекули з пластиліну (або матеріалу на вибір учня);
- Запропонувати показати конспект на оцінку за бажання.
- Домашнє завдання
Григорович О.В. Хімія.
- Читати: §5-8, стр. 25-42.
- Розв’язати: §5, стр. 28. №72; §6, стр. 35. №81, 83; §7, стр. 40. №103; §8, стр. 44. №110


про публікацію авторської розробки
Додати розробку
