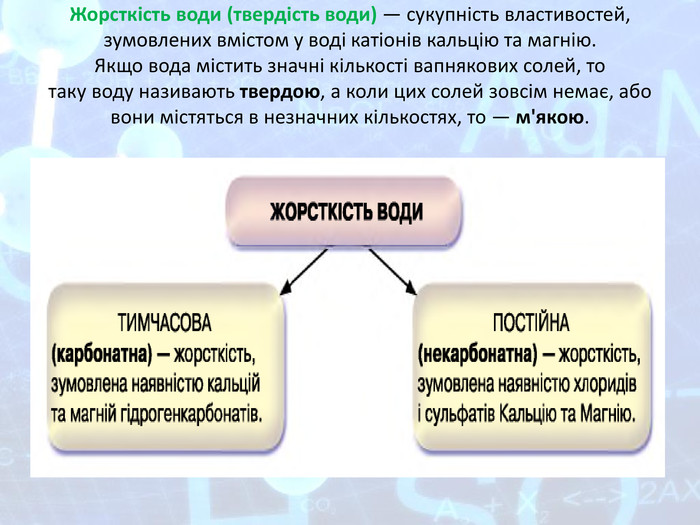
Презентація "Солі, їх поширення в природі. Середні та кислі солі. Поняття про жорсткість води та способи її усунення."
Про матеріал
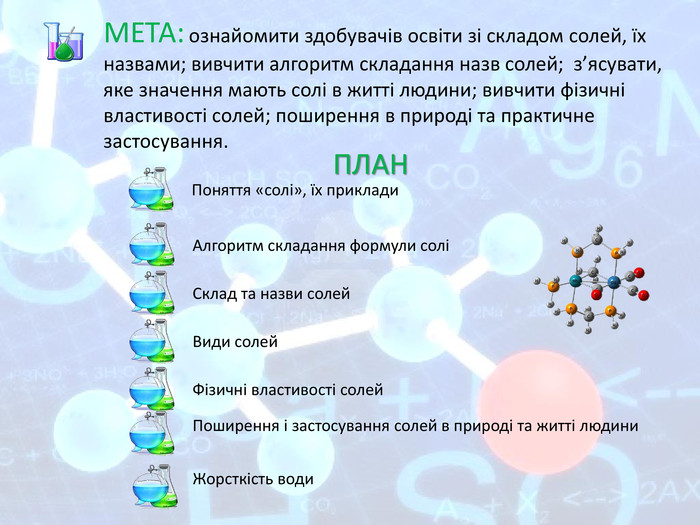
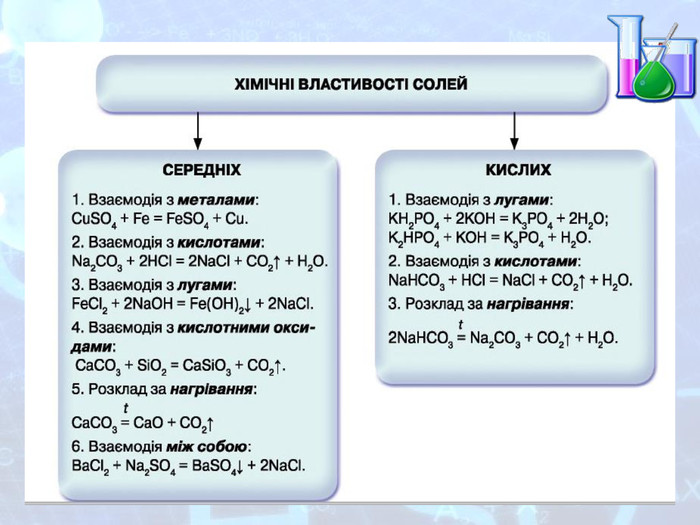
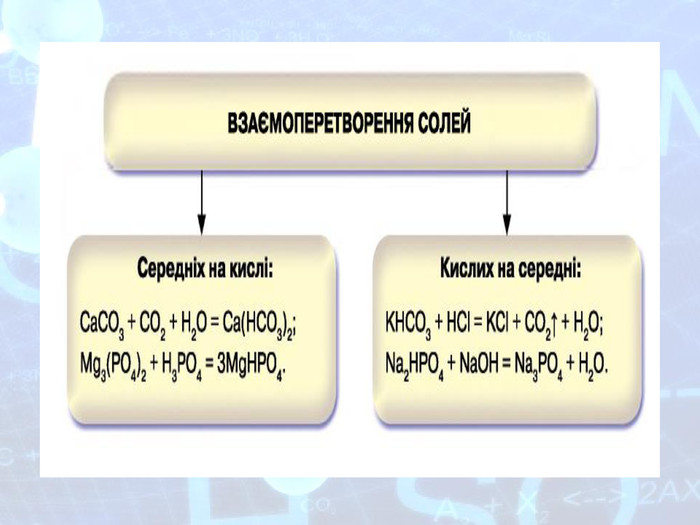
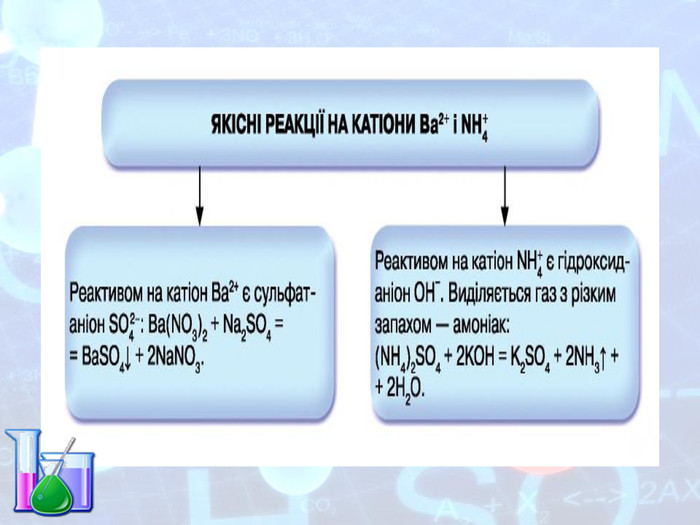
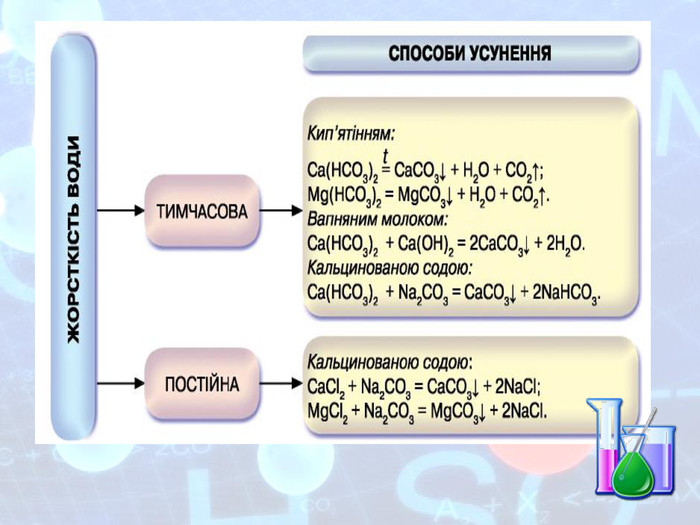
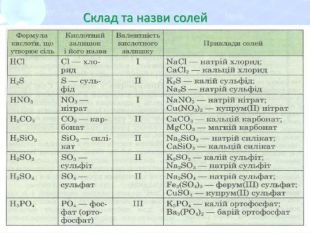
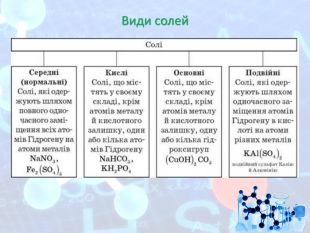
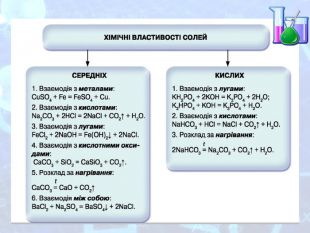
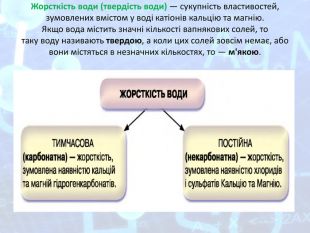
МЕТА: ознайомити здобувачів освіти зі складом солей, їх назвами; вивчити алгоритм складання назв солей; з’ясувати, яке значення мають солі в житті людини; вивчити фізичні властивості солей; поширення в природі та практичне застосування.
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку



















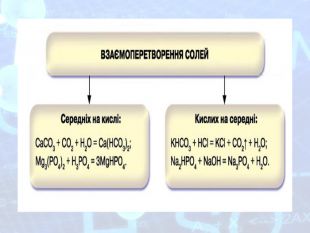
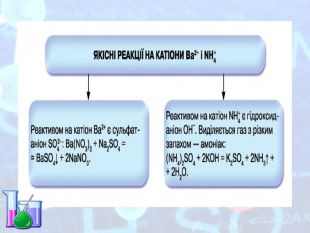
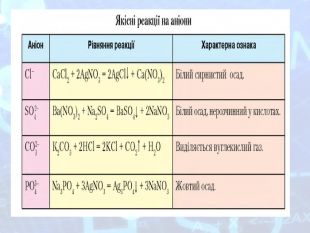

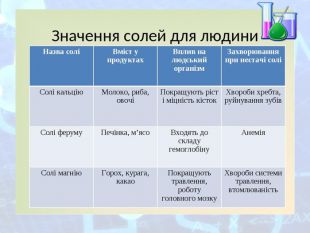






-

Фертак Наталя Володимирівна
05.03.2025 в 14:48
Щиро вдячна за роботу
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Антонюк Ольга
21.03.2024 в 16:42
Чудова презентація. Дякую!!!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Сулік Оксана Петрівна
11.03.2024 в 09:15
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Остаповець Юрій
05.03.2024 в 19:59
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Панасюк Марія
09.03.2023 в 10:45
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Товстолес Лариса
22.02.2023 в 20:44
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Ткачова Ольга
28.03.2022 в 11:39
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Арсенюк Наталія
13.03.2022 в 11:42
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Колісник Алла Вікторівна
14.11.2021 в 22:46
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Сатмарі Марія Емерихівна
04.03.2021 в 13:35
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Кузьменко Ольга Сергіївна
14.04.2020 в 15:26
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 8 відгуків