Презентація "Основи. Властивості, застосування гідроксидів Натрію і Кальцію"
Про матеріал
МЕТА : вивчити хімічні властивості основ: лугів і нерозчинних у воді гідроксидів, підтвердити їх експериментально; ознайомити учнів з їх застосуванням і фізіологічною дією на організм людини; закріпити поняття про реакцію обміну, як випадок – нейтралізації на прикладі реакцій, що характеризують хімічні властивості основ.
ПЛАН
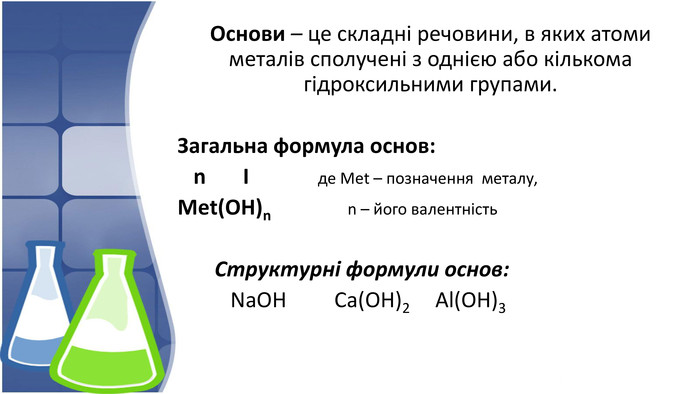
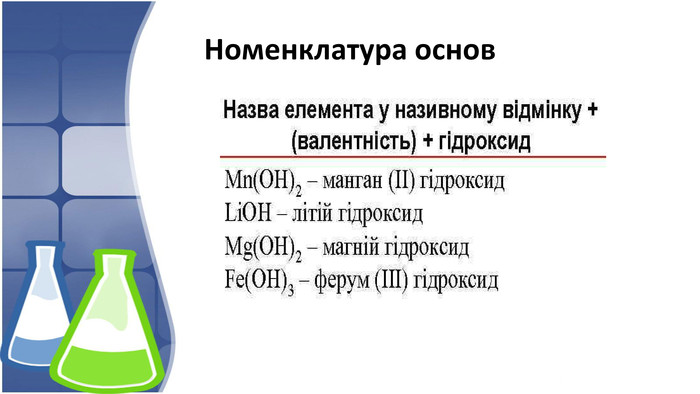
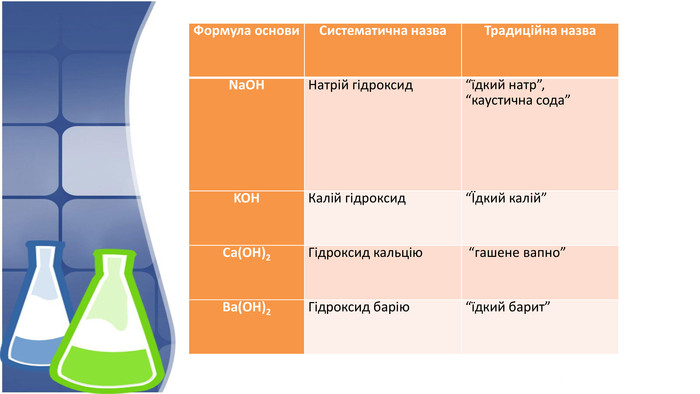
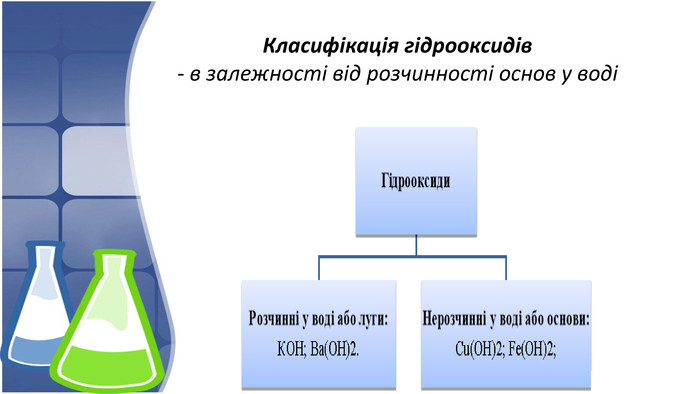
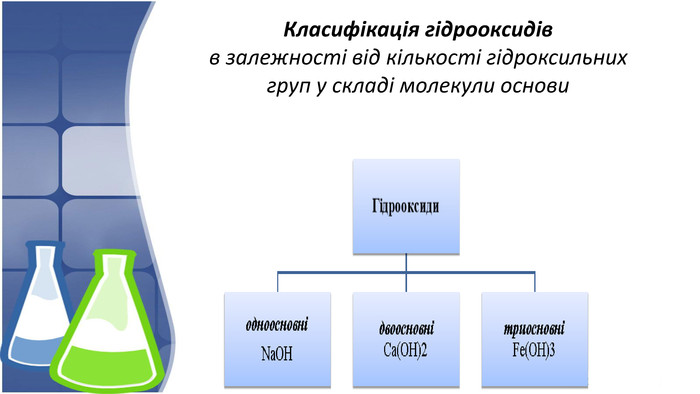
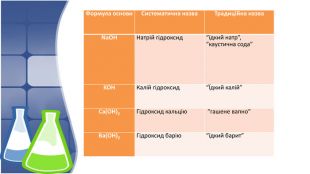
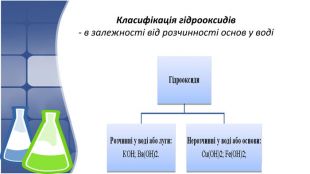
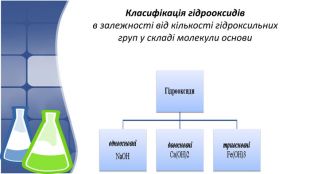
1. Поняття основи та їх гідроксильна група,класифікація 2. Фізичні властивості основ
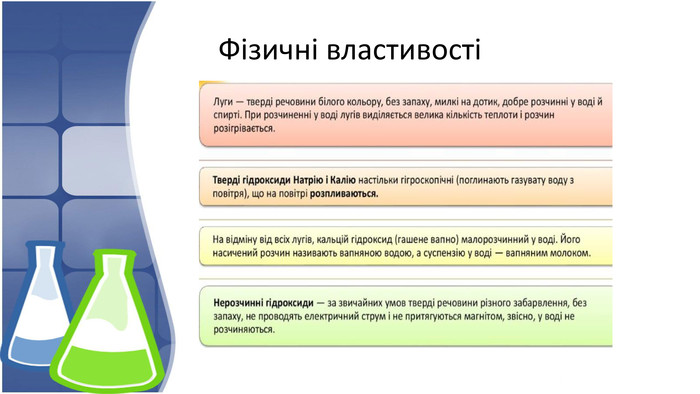
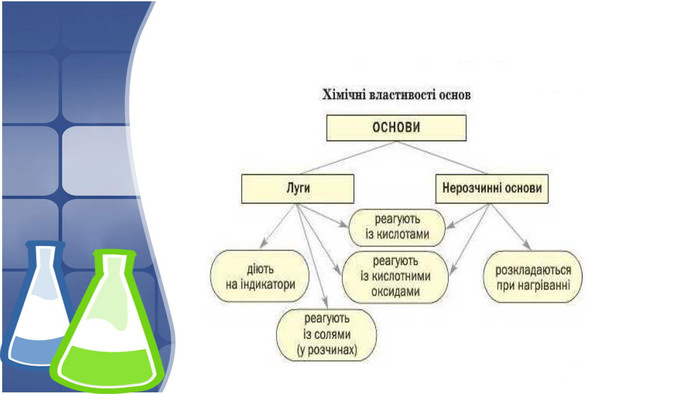
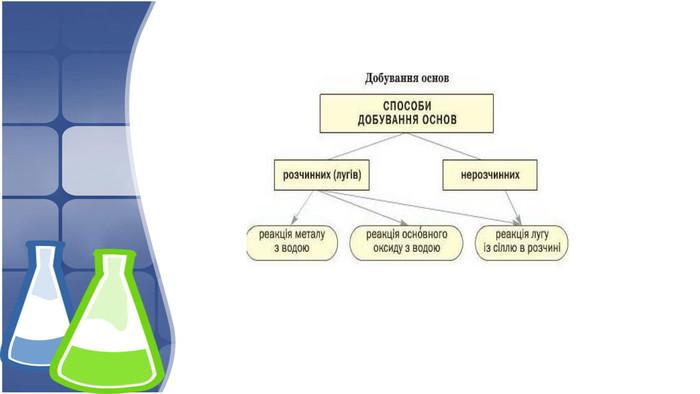
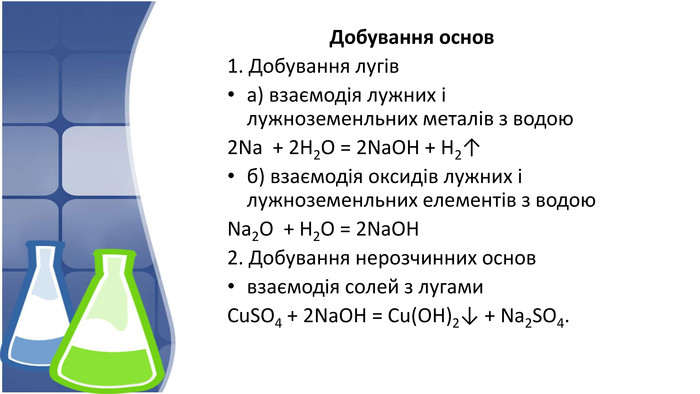
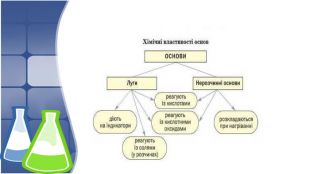
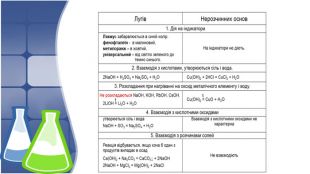
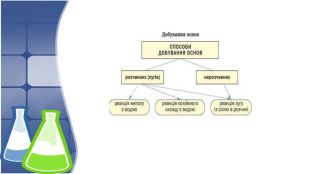
3. Хімічні властивості нерозчинних основ, добування
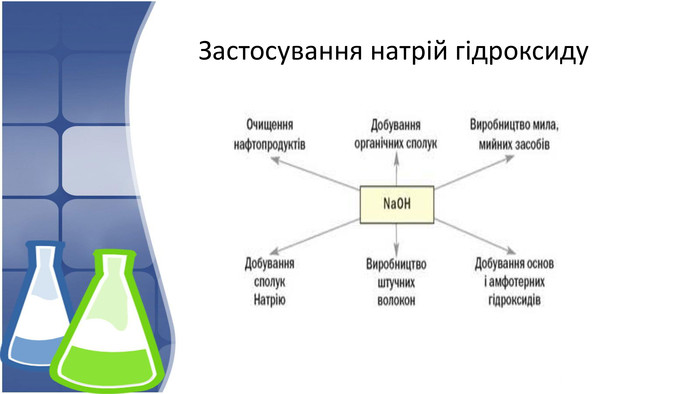
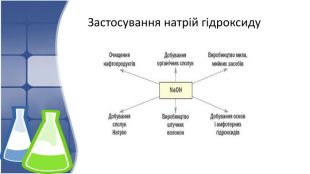
4. Застосування натрій гідроксиду
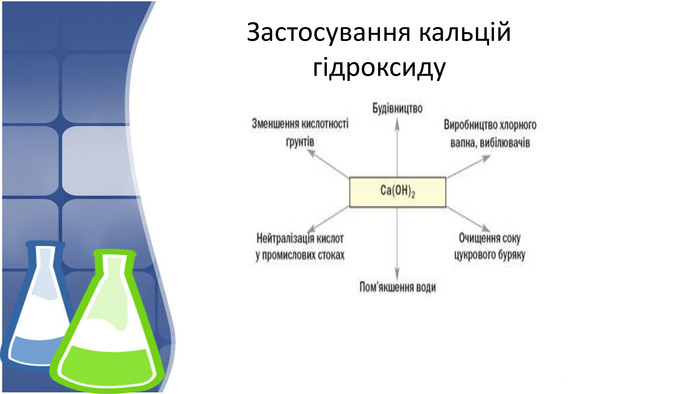
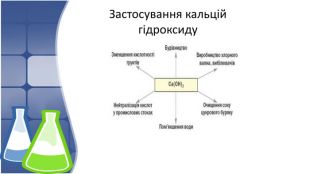
5. Застосування кальцій гідроксиду
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку














-

Брич Марія Степанівна
28.01.2026 в 15:40
ДЯКУЮ.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Антонюк Ольга
14.03.2024 в 20:50
Дякую за чудову розробку
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Пась Любов Григорівна
14.03.2024 в 08:49
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Остаповець Юрій
27.02.2024 в 19:20
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Товстолес Лариса
16.02.2023 в 22:31
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Савєнкова Ольга Євгеніївна
15.03.2022 в 10:15
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Підгорна Ольга Сергіївна
22.02.2022 в 14:30
Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Парфілко Ольга Анатоліївна
07.02.2022 в 00:28
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Іловайська Наталія Леонідівна
05.04.2021 в 19:30
Загальна:
4.3
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
4.0
-

Сатмарі Марія Емерихівна
04.03.2021 в 13:35
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Обертінська Вікторія
04.03.2021 в 02:18
Загальна:
4.3
Структурованість
5.0
Оригінальність викладу
3.0
Відповідність темі
5.0
-

Герецун Галина Михайлівна
10.02.2021 в 11:09
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Гевел Дар'я Олександрівна
08.04.2020 в 10:50
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
Показати ще 10 відгуків