Презентація "Солі, їх властивості, поширення"
Про матеріал
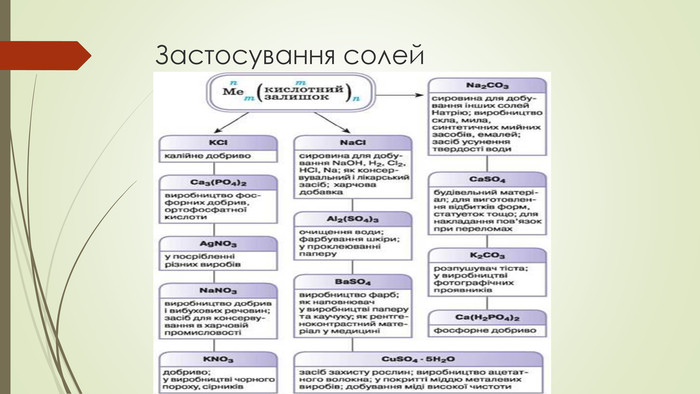
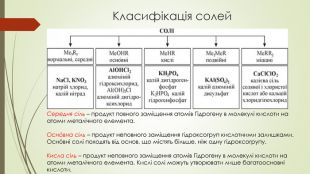
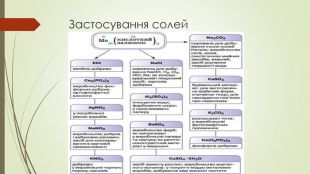
Матеріали презентації будуть корисні для проведення уроків хімії в 8, 11 класах з теми "Солі, властивості, їх поширення" Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку