Презентація уроку "Йонний зв'язок"
Про матеріал
Анімована презентація уроку "Йонний зв'язок".
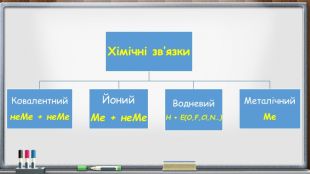
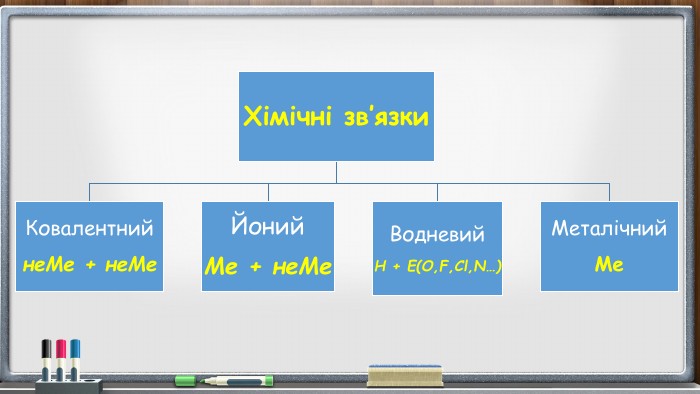
Мета: сформувати поняття про йонний зв’язок, розглянути механізм складання схем його утворення, сформувати навички відрізняти сполуки з ковалентним та йонним зв’язком. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку








![Схема утворення йонного зв’язку Mg + O Mg [ O ] 2+ 2-2 8 22 62 82 8атоматомйонйон-e-e Схема утворення йонного зв’язку Mg + O Mg [ O ] 2+ 2-2 8 22 62 82 8атоматомйонйон-e-e](/uploads/files/290614/372513/428011_images/9.jpg)