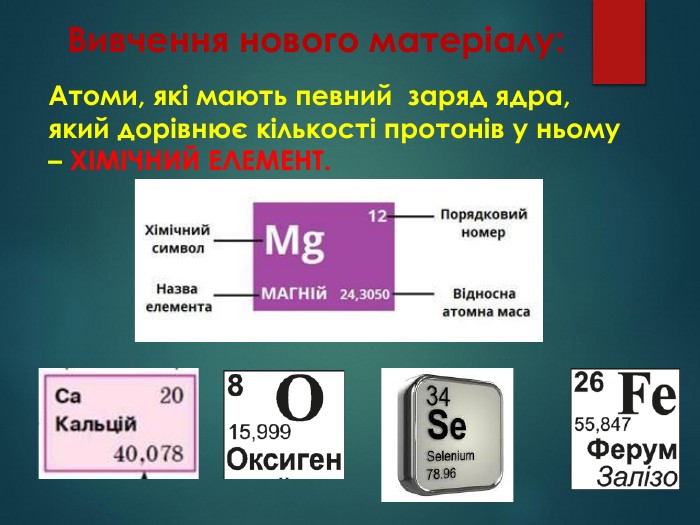
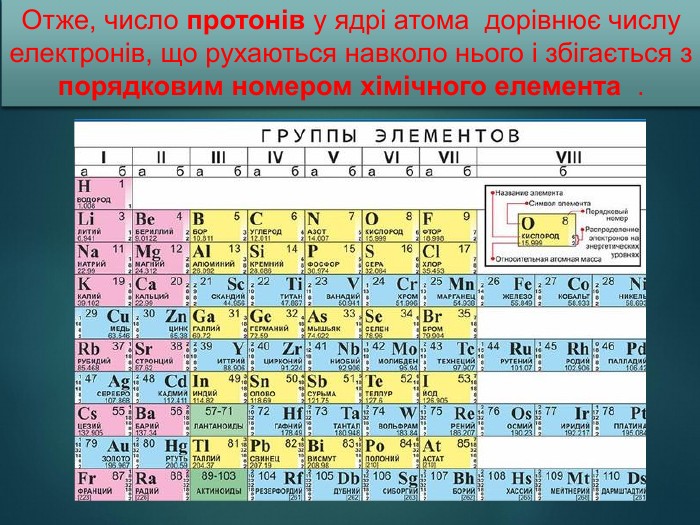
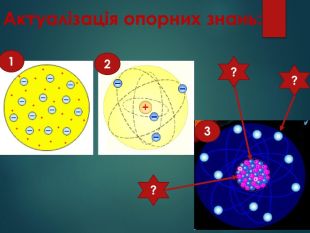
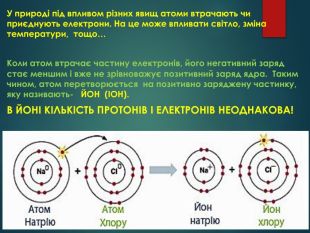
Презентація: "Відмінність хімічних елементів один від одного. Іони."
Про матеріал
Презентація призначена для використання на уроках предмету "Навколишній світ" , за педагогічною технологією "Росток". 5 клас. Перегляд файлу
Зміст слайдів
ppt
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку