Презентація «Взаємодія води з оксидами металічних елементів». 7 клас
Про матеріал
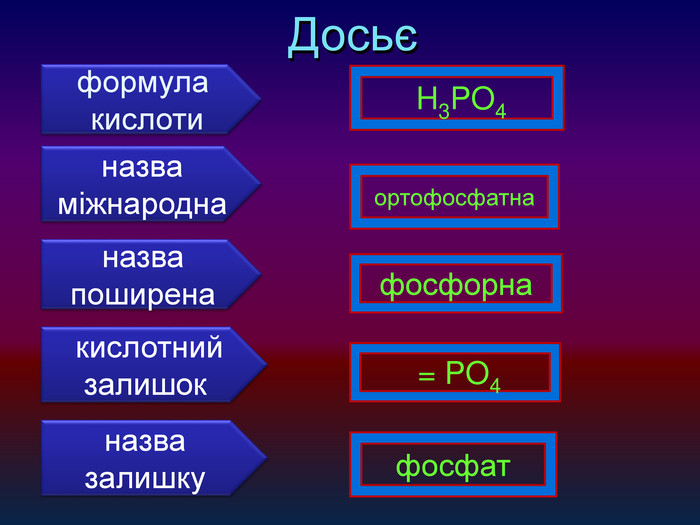
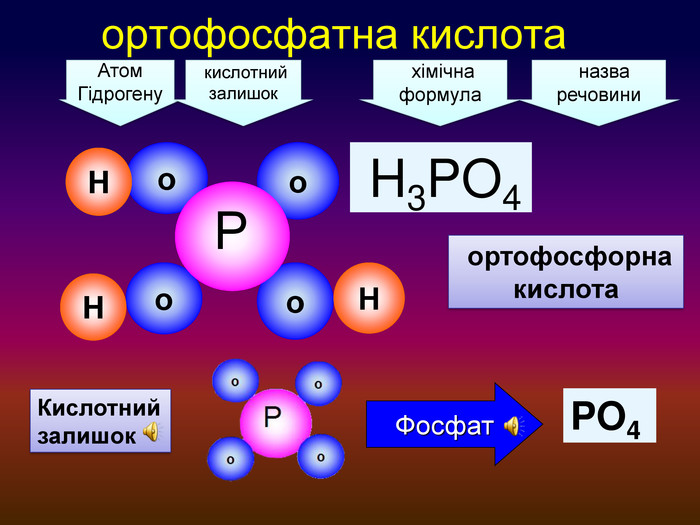
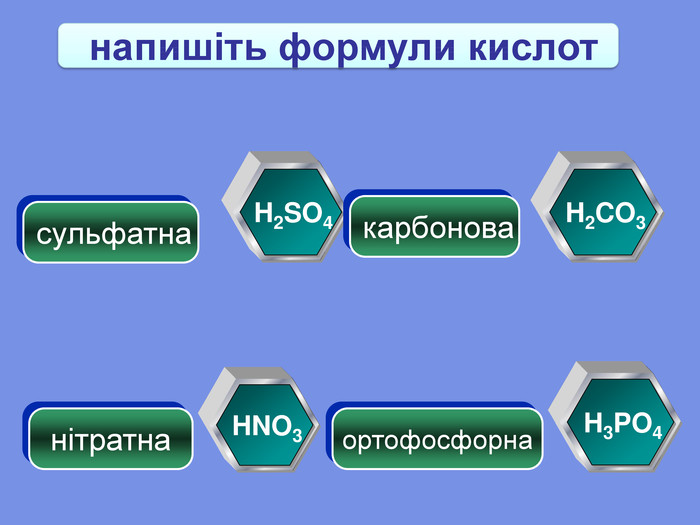
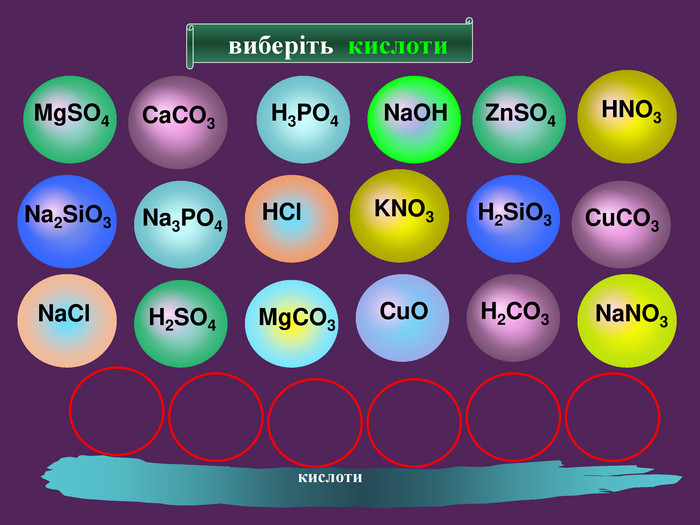
| Взаємодія води з оксидами металічних елементів. Поняття про основи. Поняття про індикатори. |
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку



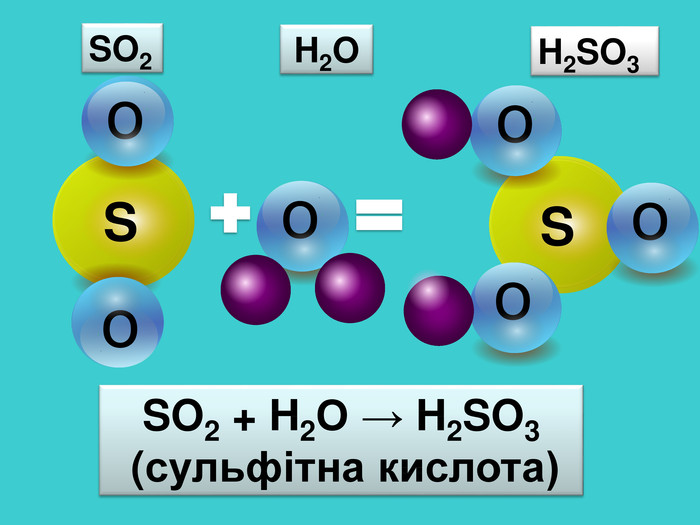
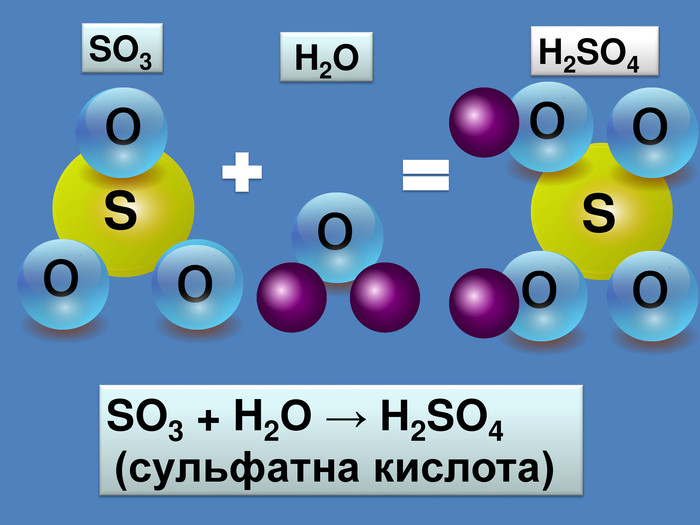

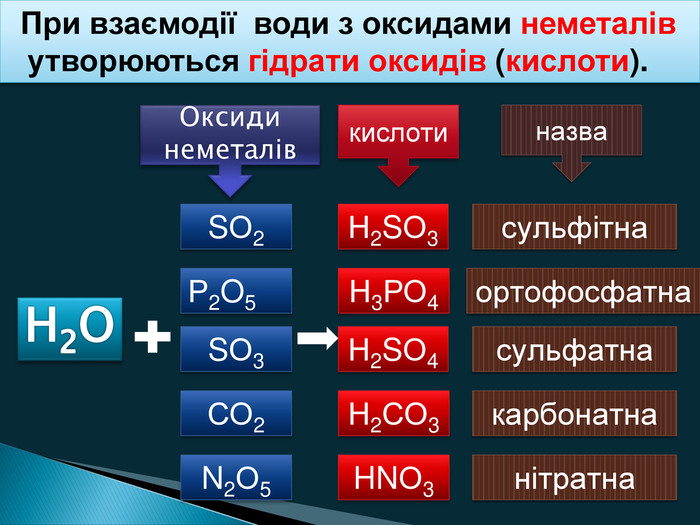





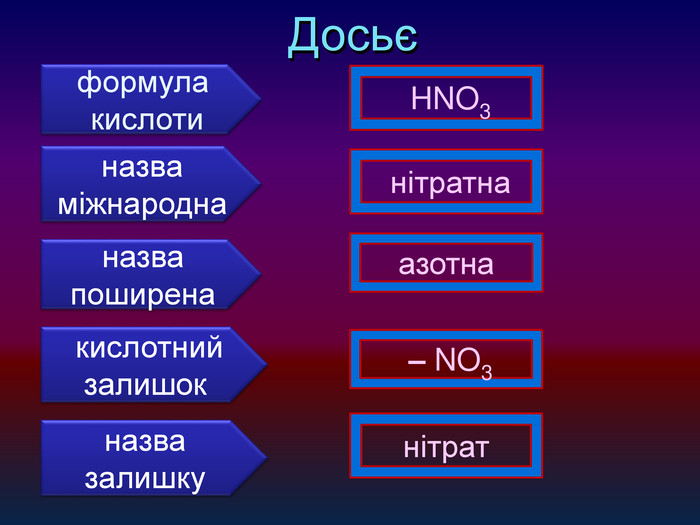
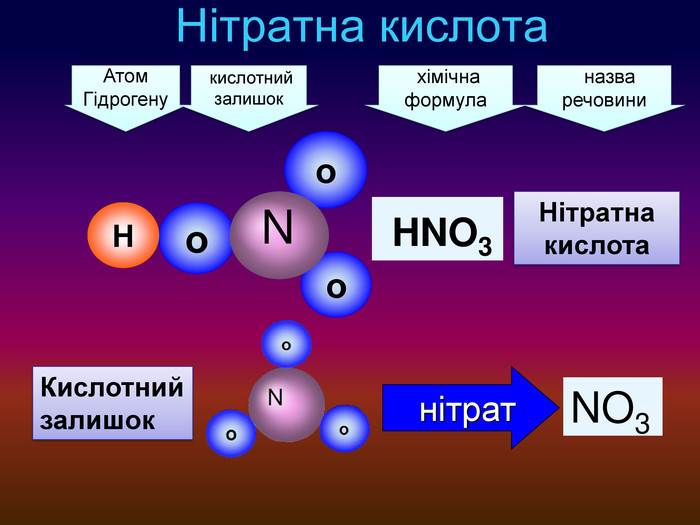
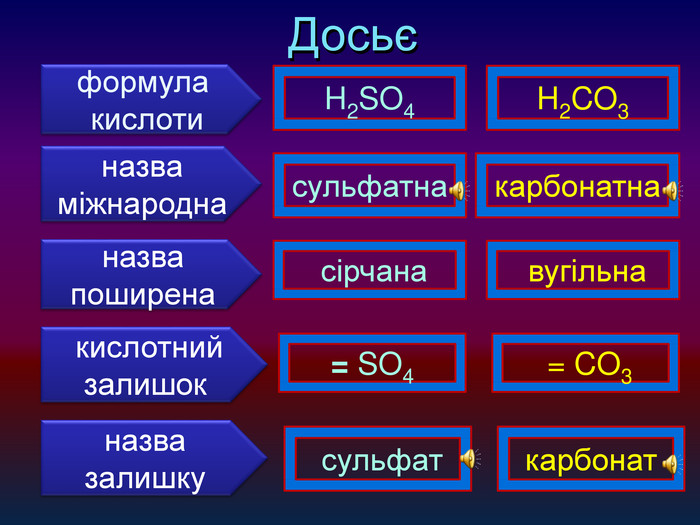
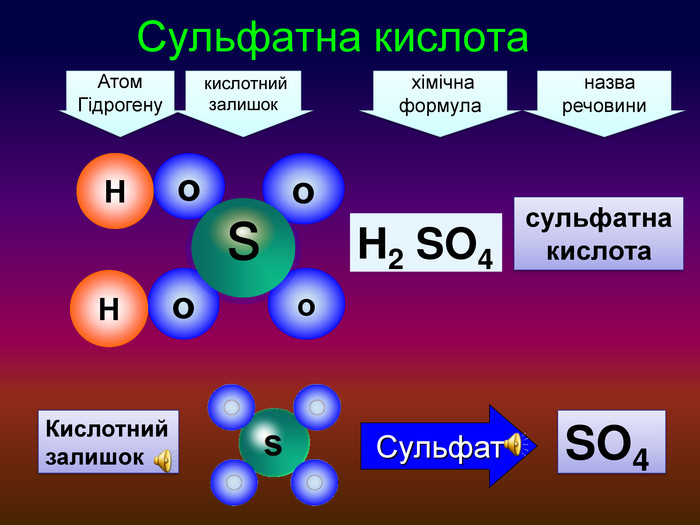
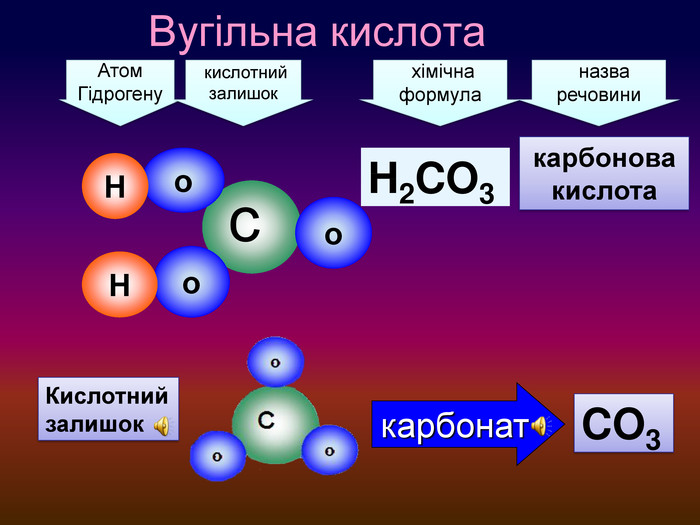









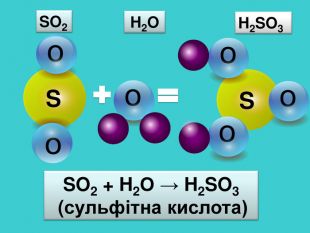
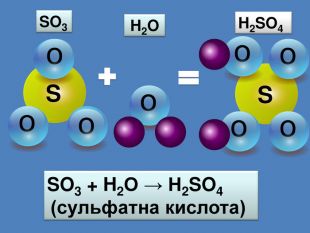
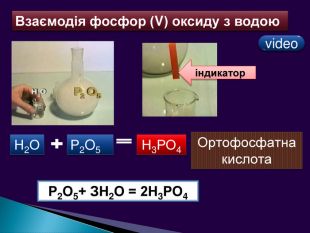




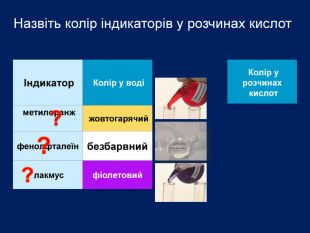



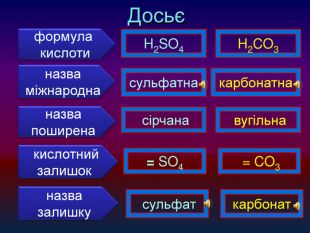
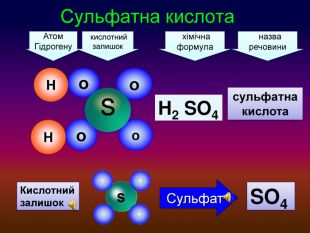
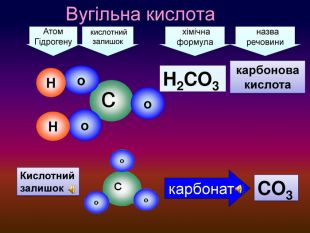
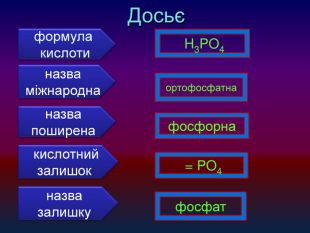
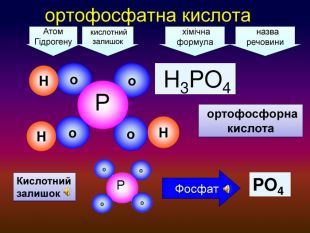





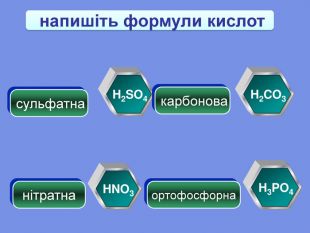
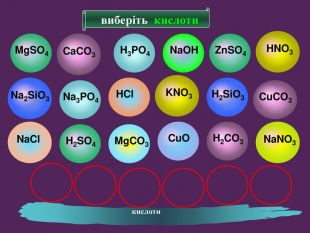


-

Березняк Ілля Юрійович
04.05.2020 в 16:50
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Д'яченко Галина Володимирівна
26.04.2020 в 11:15
Дякую! Приклад того, якою повинна бути презентація до уроку!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Немеш Тетяна Вікторівна
12.04.2020 в 13:40
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Гонтар Валентина Дмитрівна
16.03.2018 в 13:31
+
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Паращак Наталія Миколаївна
16.03.2018 в 10:58
Хороший матеріал до уроку. Науково, пізнавально та цікаво. Дякую за можливість використати у своїй роботі.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 2 відгука