Презентація «Розчин і його компоненти. Масова частка розчиненої речовини». 7 клас
| Розчин і його компоненти: розчинник, розчинена речовина. Якісний склад розчину. Масова частка розчиненої речовини. Виготовлення розчину. Розрахункові задачі 4. Обчислення масової частки, маси розчиненої речовини, маси і об'єму води в розчині. |

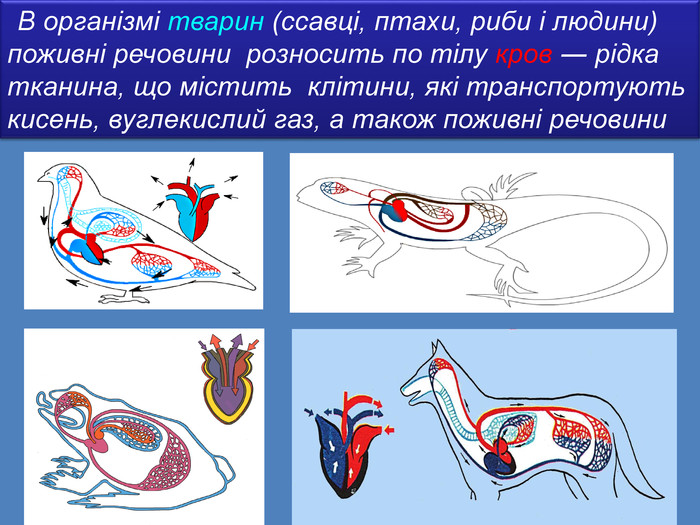



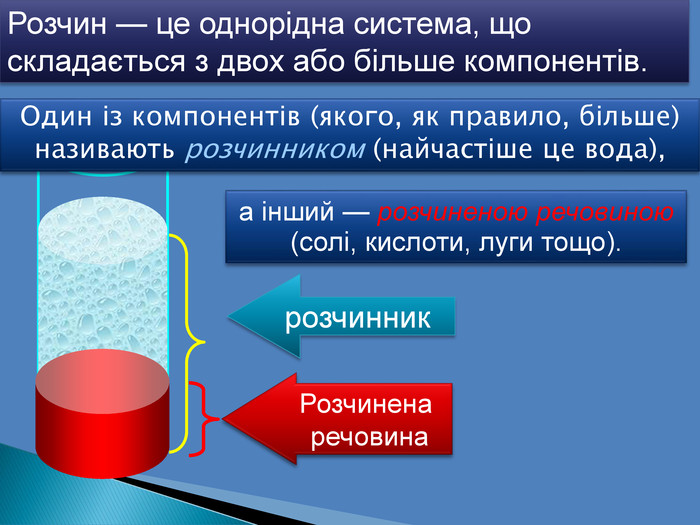













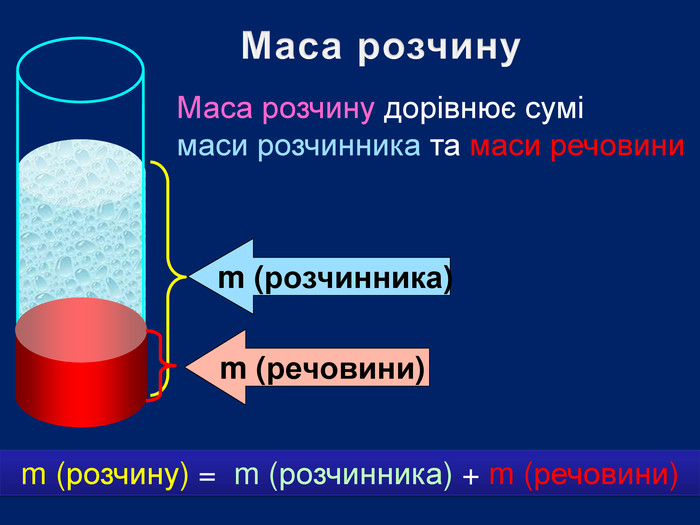









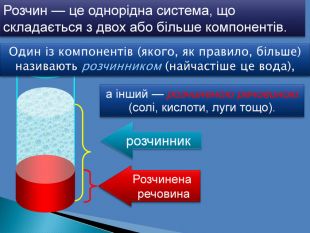
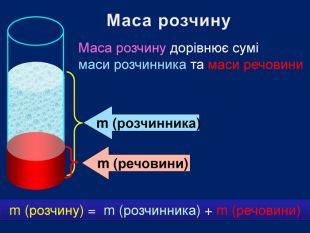
В 1грамі розчину міститься 0,05г речовини. В 10 грамах розчину міститься 0,5г речовини. В 100 грамах розчину міститься 5г речовини Для цього обраховують скільки грамів речовини розчинено в одному грамі води Працюючи з розчинами, важливо знати, скільки розчиненої речовини в них міститься
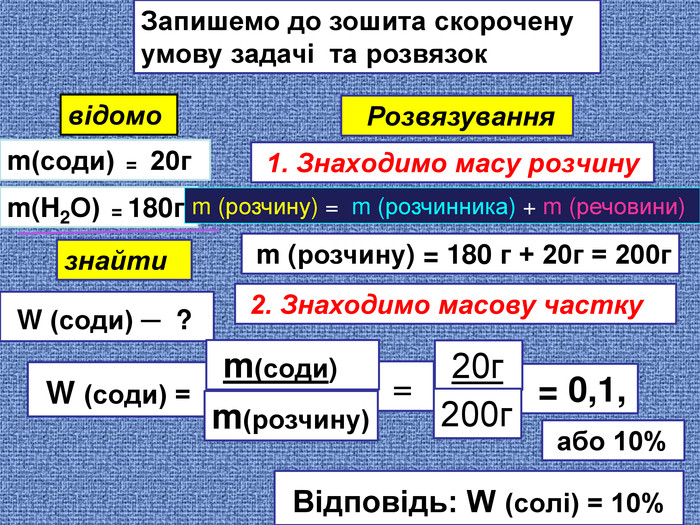
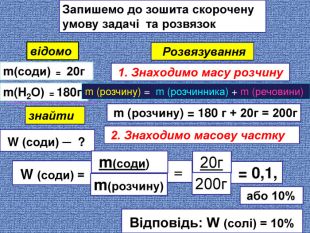
Запишемо до зошита скорочену умову задачі та розвязоквідомоm(соди) = 20гm(H2 О) = 180г знайти W (соди) ─ ? Розвязування 1. Знаходимо масу розчинуm (розчину) = m (розчинника) + m (речовини) m (розчину) = 180 г + 20г = 200г 2. Знаходимо масову частку W (соди) = = 0,1, = або 10% Відповідь: W (солі) = 10% 20г m(соди) 200г m(розчину)
Задача. У 100 г води розчинено 15г калій нітрату КNO3. Визначити масову частку нітрату калію в розчині.відомо Розвязуваннязнайтиm(H2 О) = 100г W (KNО3) ─ ? m (розчину) = 100 г +15г =115гm(KNО3) = 15гm (розчину) = m (розчинника) + m (речовини) 1. Знаходимо масу розчину 2. Знаходимо масову частку Відповідь: W (KNО3) =13%
Задача. Яку масу калій перманганату КMn. O4 та води необхідно взяти для приготування 350г розчину, з масовою часткою 0,08 Усвідомлюємо завдання. Що необхідно зробити?Приготувати розчин. Яка маса розчину має бути ? m(розчину) = 350г. Яка масова частка речовини в розчині ? W(солі) = 0,08
Запишемо скорочену умову задачіВідомо m(розчину) = 350г W(солі) = 0,08 Знайти m(KMn. O4)-? m(H2 О)-?Розвязування 1. Знаходимо масу речовини m (KMn. O4) = m (розчину) * W m (KMn. O4) = 350г * 0,08 = 28 г 2. Обчислюємо масу водиm (H2 О) = m (розчину) ─ m(KMn. O4)m (H2 О) = 350г ─ 28г = 322 г
Задача. Яку масу хлориду калію КCl необхідно взяти для приготування розчину масою 1 кілограм з масовою часткою розчиненої речовини 5%W (КCl) = 5% = 0,05 Приготуваня розчину з відомою масовою часткою відомоm розчину = 1 кг =1000г знайтиm(H2 О) ─? m(КCl) ─? Розвязування 1. Обчислюємо масу соліm(КCl) = W· m розчину m(КCl) = 0,05· 1000г = 50г 2. Обчислюємо масу водиm (розчину) = m (H2 О) + m (КCl)m (H2 О) = m (розчину) ─ m (КCl)m (H2 О) = 1000г ─ 50г = 950гm(КCl) = 0,05· 1000г = 50г
Задача. Яку масу калій нітрату КNO3 та води необхідно взяти для приготування 200 г розчину, з масовою часткою 8% відомо Розв’язування. Знайти ?m (озчину) = 200г W (KNО3) = 8% m (KNО3) ― ? 1. Знаходимо масу речовини Відповідь: m (KNО3) = 16 гm (H2 О) = 184г m (KNО3) = m (розчину) * W m (KNО3) = 200 г * 0,08 = 16гm(H2 О) ― ? 2. Знаходимо масу водиm (розчину) = m (H2 О) + m (речовини)m (H2 О) = m (розчину) ― m (KNО3) m (H2 О) = 200г ― 16г = 184г
П. П. Попель, Л,С. Крикля Хімія. Підручник для 7 кл. Київ. Видавничий центр “Академія”, 2016 Григорович О. В. Хімія.7 клас Розробки уроків Х.: Вид-во “Ранок”, 2007. Шаповалов С. А. Довідник старшокласниката абітурієнта. Х. Торсінг, 2005. Старовойтова І. Ю. Усі уроки хімії. 7 клас. Х.: Вид. група “Основа”, 2007. Хімія. Практичний довідник 7-9 клас. / Авт.-упорядник Курмакова І. М. та інші – Чернігів: КММЕДІА, 2015.


про публікацію авторської розробки
Додати розробку





























-

Шубіна Вікторія Вікторівна
01.04.2024 в 20:48
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Воронівська Наталья Гуріївна
18.03.2023 в 22:41
Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Колесник Алла
02.05.2022 в 20:40
Щиро дякую за чудову роботу!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Совпель Ольга Вікторівна
27.04.2022 в 09:53
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Крупа Наталія Іванівна
05.05.2021 в 21:39
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Konska Olenka
13.04.2021 в 22:43
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Єнікеєва Тетяна Степанівна
01.04.2021 в 22:05
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Підкалюк Любов Петрівна
30.03.2021 в 11:36
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Німець Люба
07.03.2021 в 11:58
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Сало Оксана
21.04.2020 в 11:24
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Гринь Людмила Валентинівна
12.04.2020 в 18:56
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Осіпчук Валентина
04.04.2020 в 09:37
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Артюх Ігор
31.03.2020 в 18:44
Чудово
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Мушій Валентина Миколаївна
03.03.2019 в 18:01
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Ханіна Оксана
02.05.2018 в 22:23
Дякую.
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Гонтар Валентина Дмитрівна
16.03.2018 в 13:37
Цікаво і доступно
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 13 відгуків