Презентація "Явище періодичної зміни властивостей елементів і їхніх сполук на основі уявлень про електронну будову атомів"

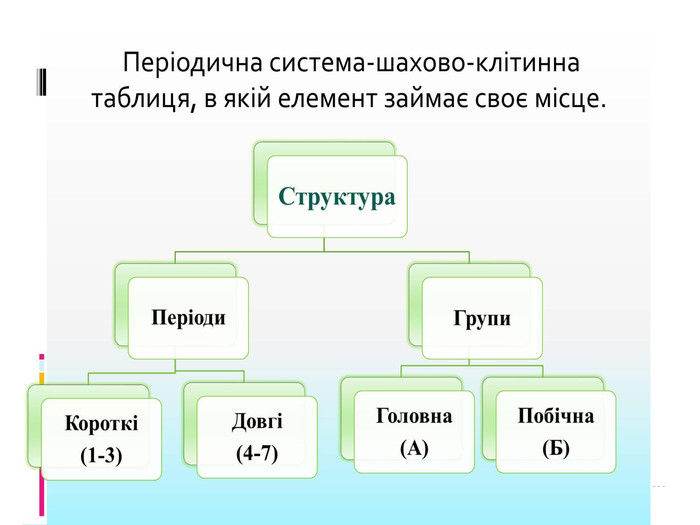










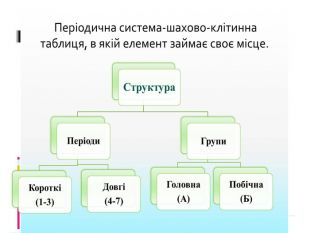
Періодична система. Короткий варіант періодичної таблиці містить 8 груп, які прийнято нумерувати римськими цифрами (I—VIII). Кожна група тут розділена на 2 підгрупи: головну(А) і побічну (В). Символи елементів головних підгруп зміщено ліворуч від центру клітинок, а символи елементів побічних підгруп — праворуч. До головних підгруп входять лише s- і p-елементи (які можуть бути як металічними, так і неметалічними). У цих елементів кількість електронів у зовнішньому енергетичному рівні збігається з номером групи: Отже, номер групи (головної підгрупи) вказує на кількість електронів у зовнішньому енергетичному рівні, а також на значення вищої валентності (за винятком Оксигену, Флуору та більшості інертних елементів). Побічними називають підгрупи, що складаються з елементів, у яких заповнюється d-підрівень. їхні атоми містять у зовнішньому рівні по два електрони (або по одному — у разі «провалу»). Побічні підгрупи не містять елементів перших трьох періодів. До їхнього складу входять лише металічні елементи, які називають перехідними: вони розміщені всередині великих періодів (парних рядів).
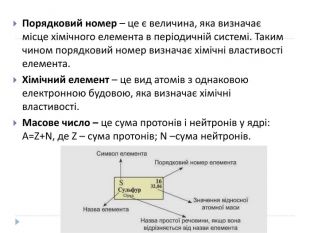
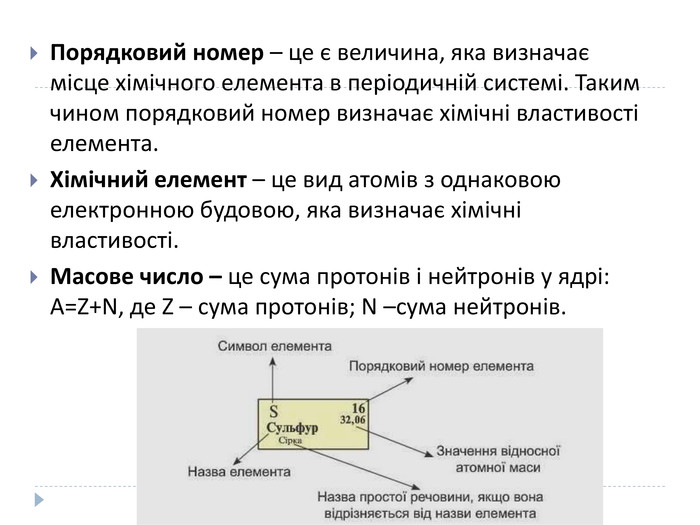
Порядковий номер – це є величина, яка визначає місце хімічного елемента в періодичній системі. Таким чином порядковий номер визначає хімічні властивості елемента. Хімічний елемент – це вид атомів з однаковою електронною будовою, яка визначає хімічні властивості. Масове число – це сума протонів і нейтронів у ядрі: A=Z+N, де Z – сума протонів; N –сума нейтронів.
Формулювання періодичного закону:І. Формулювання Д.І. Менделєєва:властивості речовин (хімічних елементів) змінюютьсяперіодично по мірі зростання атомних мас.ІІ. Формулювання сучасне (ядерне):хімічні властивості, а також інші властивості змінюються періодично по мірі зростання заряду ядра атома.ІІІ. Формулювання – сучасне: Властивості елементів, особливо хімічні, змінюються періодично по мірі зростання порядкового номера. Це пояснюється тим, що по мірі зростання порядковогономера періодично змінюється електронна будова (за квантово-механічними властивостями).
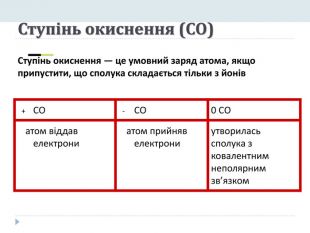
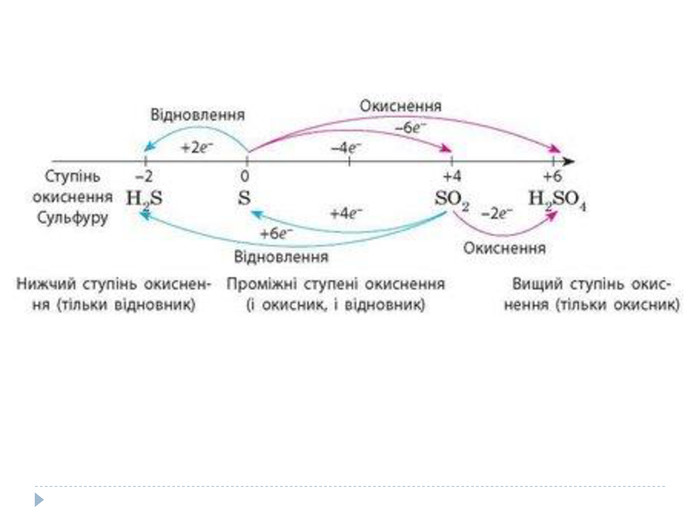
Валентність і ступінь окиснення. Максимальна валентність атомів елементів та їхні ступені окиснення відповідають номеру групи, у якій розміщується елемент у періодичній системі. Мінімальний ступінь окиснення визначають за кількістю приєднаних атомом електронів, щоб його зовнішній енергетичний рівень став завершеним. (Всі елементи бажають стану “інертного газу”)(8-номер групи елемента). Сума СО у бінарних(подвійних) сполуках дорівнює 0.
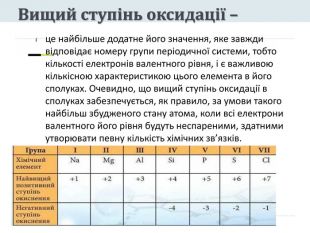
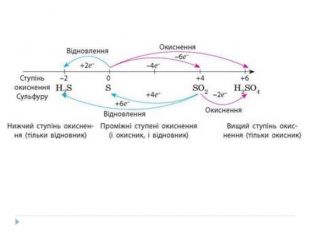
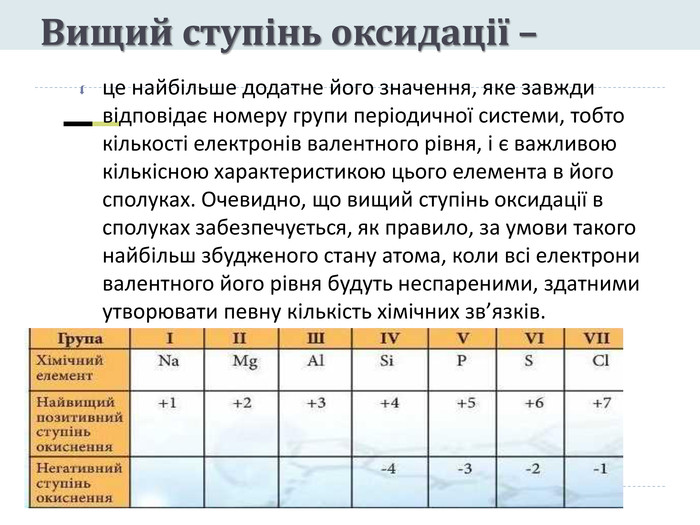
Вищий ступінь оксидації – це найбільше додатне його значення, яке завжди відповідає номеру групи періодичної системи, тобто кількості електронів валентного рівня, і є важливою кількісною характеристикою цього елемента в його сполуках. Очевидно, що вищий ступінь оксидації в сполуках забезпечується, як правило, за умови такого найбільш збудженого стану атома, коли всі електрони валентного його рівня будуть неспареними, здатними утворювати певну кількість хімічних зв’язків.
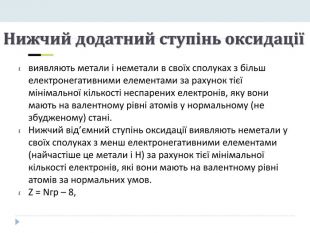
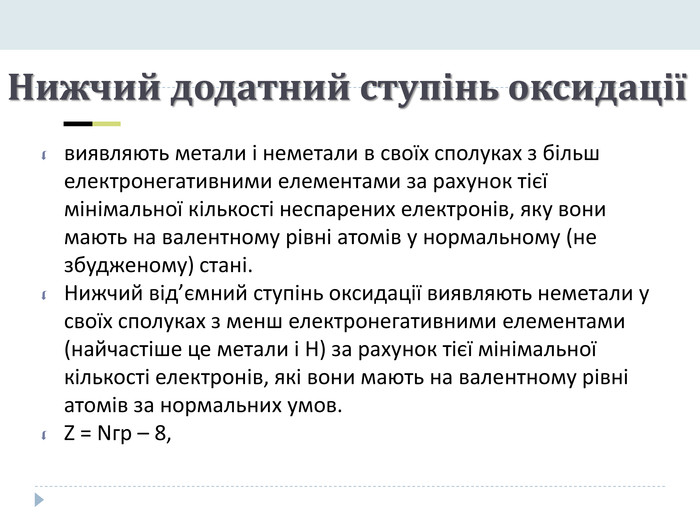
Нижчий додатний ступінь оксидації виявляють метали і неметали в своїх сполуках з більш електронегативними елементами за рахунок тієї мінімальної кількості неспарених електронів, яку вони мають на валентному рівні атомів у нормальному (не збудженому) стані. Нижчий від’ємний ступінь оксидації виявляють неметали у своїх сполуках з менш електронегативними елементами (найчастіше це метали і Н) за рахунок тієї мінімальної кількості електронів, які вони мають на валентному рівні атомів за нормальних умов. Z = Nгр – 8,
Закономірності зміни ступенів оксидації елементів у періодах зліва направо:- поступове зростання додатних значень від +1 до +8;- поступове зростання від’ємних значень від -4 до -1 (серед неметалів);- сума абсолютних значень нижчого від’ємного і вищого додатного ступенів оксидації елементів однієї групи дорівнює восьми.
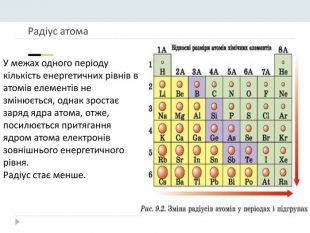
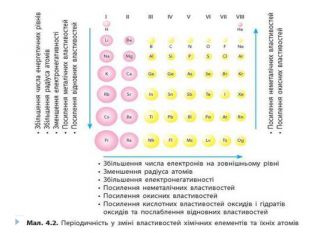
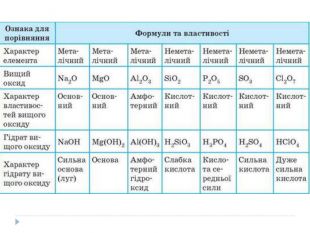
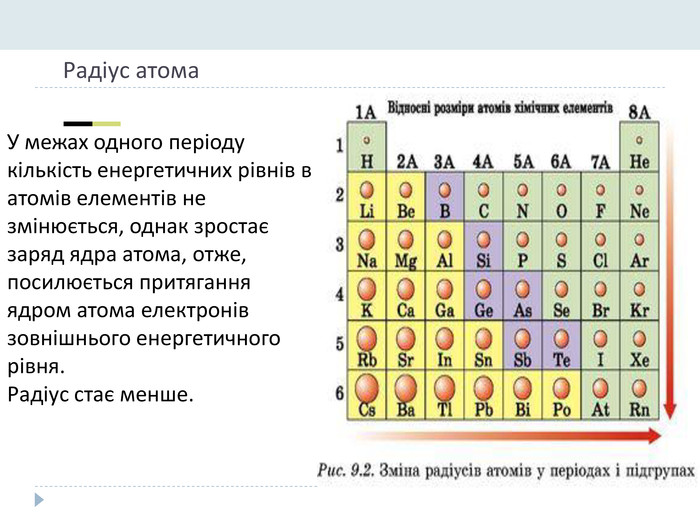
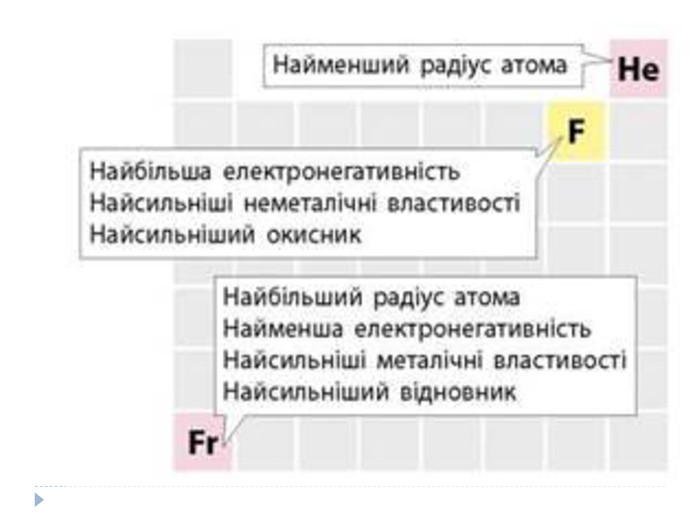
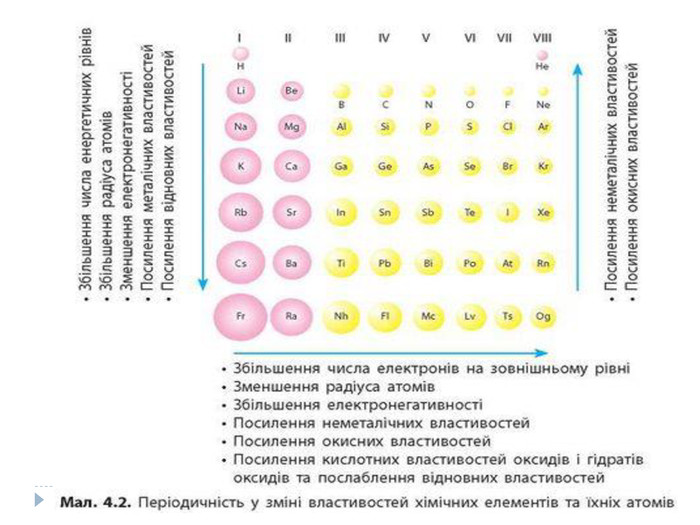
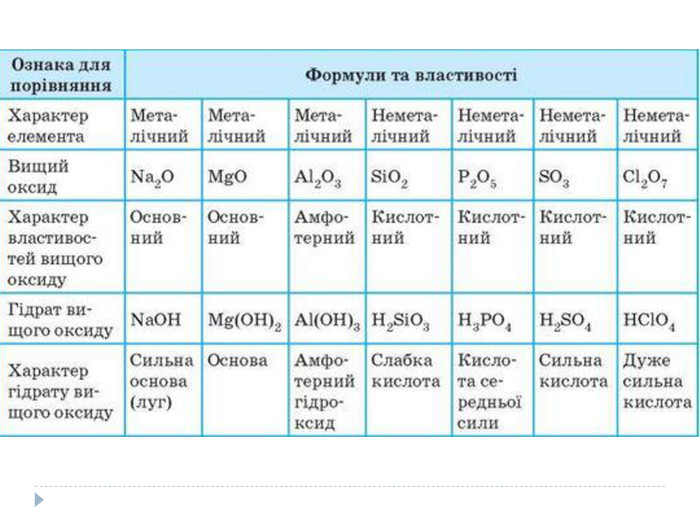
Основні закономірності Зміни властивостей елементів. У межах окремих періодів зі збільшенням заряду ядер:• зменшується атомний радіус, тому що зростає сила притягання електронів до ядра;• послаблюються металічні властивості елементів і посилюються неметалічні;• енергія іонізації для елементів одного періоду зростає зліва направо;• збільшується максимальний позитивний ступінь окиснення елемента (за винятком Оксигену і Флуору, в яких немає ступенів окисненя +6 і +7 відповідно);• послаблюються основні властивості оксидів і гідроксидів елементів, одночасно підвищуються їхні кислотні властивості.
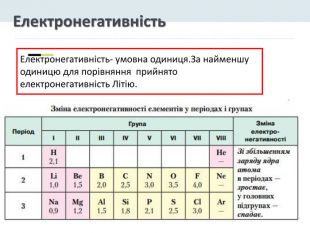
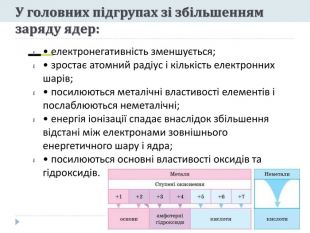
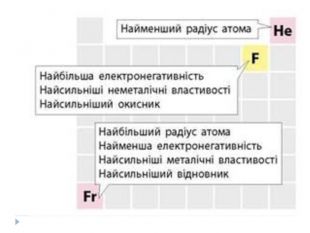
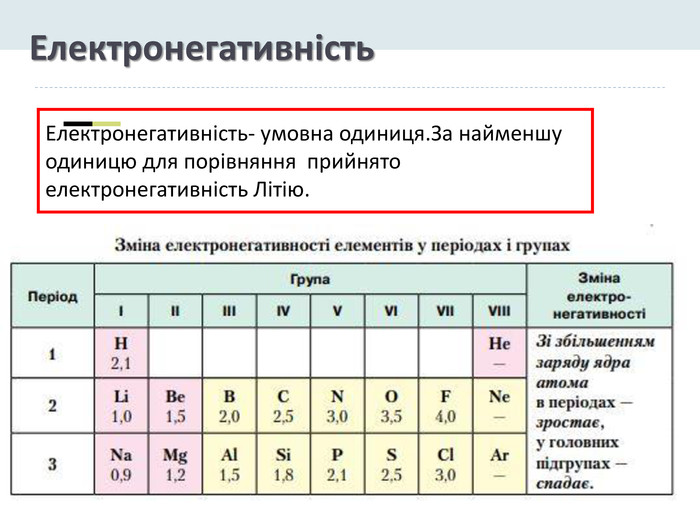
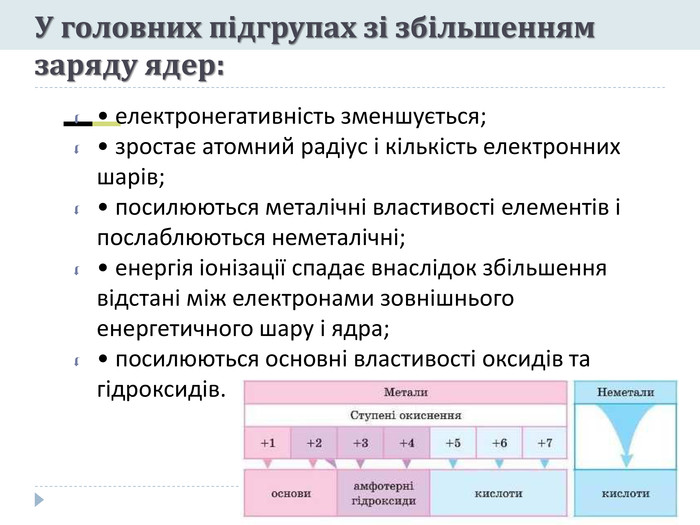
У головних підгрупах зі збільшенням заряду ядер:• електронегативність зменшується;• зростає атомний радіус і кількість електронних шарів;• посилюються металічні властивості елементів і послаблюються неметалічні;• енергія іонізації спадає внаслідок збільшення відстані між електронами зовнішнього енергетичного шару і ядра;• посилюються основні властивості оксидів та гідроксидів.


про публікацію авторської розробки
Додати розробку