Презентація з теми: "Властивості і застосування карбонатів, нітратів і ортофосфатів лужних і лужноземельних металічних елементів, солей амонію"
















1) Фізичні властивості карбонатної кислоти: H2 CO3 Рідина без кольору та запаху. Mr(H2 СО3) = 62 M (Н2 СО3) = 62 г/моль. Проявляє слабкі кислотні властивостіДвоосновна ОксигеновміснаІснує лише у вигляді водного розчину. Легко розкладається (за н. у.) на вуглекислий газ і воду. Тверді речовини з йонною кристалічною ґраткою
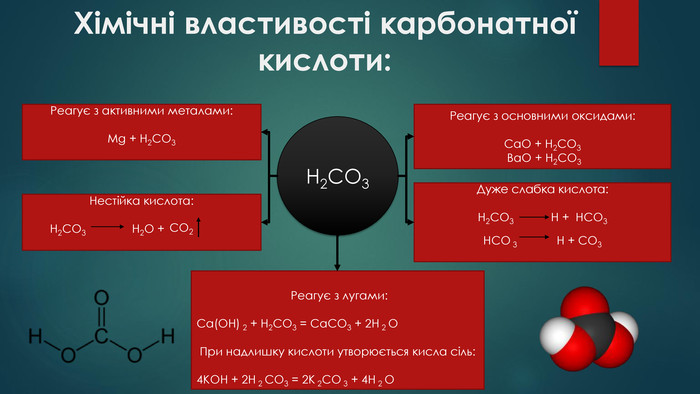
Хімічні властивості карбонатної кислоти: H2 CO3 Реагує з активними металами: Mg + H2 CO3 Нестійка кислота: H2 CO3 Н2 О + Реагує з основними оксидами: Сa. O + H2 CO3 Ba. O + H2 CO3 Дуже слабка кислота: H2 CO3 Н + НСО3 НСО 3 Н + СО3 Реагує з лугами: Са(ОН) 2 + Н2 СО3 = Ca. CO3 + 2 H 2 OПри надлишку кислоти утворюється кисла сіль:4 КОН + 2 Н 2 СО3 = 2 K 2 CO 3 + 4 H 2 O СО2
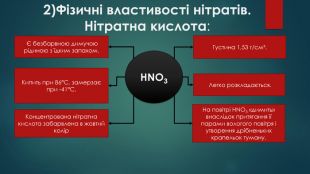
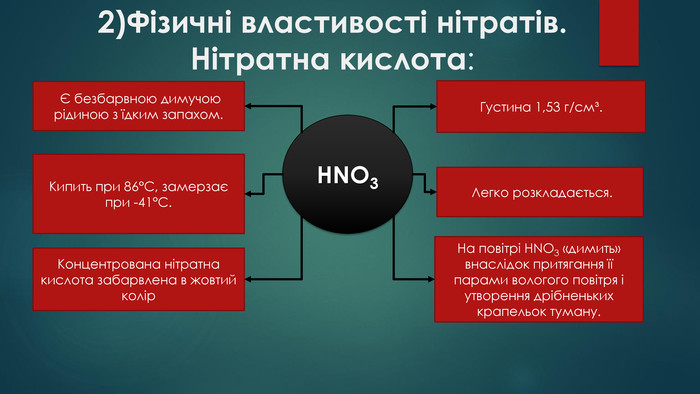
2)Фізичні властивості нітратів. Нітратна кислота: HNO3 Є безбарвною димучою рідиною з їдким запахом. Легко розкладається. Концентрована нітратна кислота забарвлена в жовтий колір. Густина 1,53 г/см³. Кипить при 86°С, замерзає при -41°С. На повітрі HNO3 «димить» внаслідок притягання її парами вологого повітря і утворення дрібненьких крапельок туману.
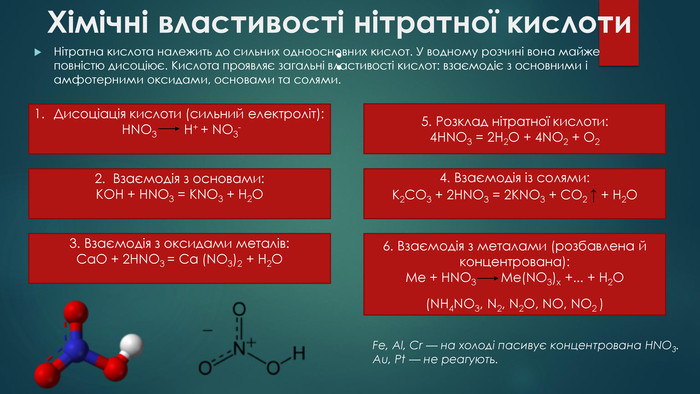
Хімічні властивості нітратної кислоти : Нітратна кислота належить до сильних одноосновних кислот. У водному розчині вона майже повністю дисоціює. Кислота проявляє загальні властивості кислот: взаємодіє з основними і амфотерними оксидами, основами та солями. Дисоціація кислоти (сильний електроліт): HNO3 H+ + NO3-2. Взаємодія з основами: KOH + HNO3 = KNO3 + H2 O3. Взаємодія з оксидами металів: Ca. O + 2 HNO3 = Ca (NO3)2 + H2 O4. Взаємодія із солями: K2 CO3 + 2 HNO3 = 2 KNO3 + CO2 ↑ + H2 O5. Розклад нітратної кислоти:4 HNO3 = 2 H2 O + 4 NO2 + O26. Взаємодія з металами (розбавлена й концентрована): Me + HNO3 Me(NO3)х +... + H2 O (NH4 NO3, N2, N2 O, NO, NO2 ) Fe, Al, Cr — на холоді пасивує концентрована HNO3. Au, Pt — не реагують.
Фізичні властивості нітратів. Солі нітратної кислоти називають нітратами. Всі нітрати – тверді кристалічні речовини. Добре розчинні у водіМалостійкі при високій температуріНа відміну від хлоридів, які плавляться, не розкладаючись, нітрати розкладаються при температурі близькій до температури їх плавлення
Хімічні властивості нітратів:1. Реагують з кислотами, якщо утворюється осад: Ba(NO3)2 + H2 SO42. Реагують з лугами, якщо утворюється осад або виділяється амоніак: Fe(NO3) 3+Na. OH = Fe(OH) 3 ↓ + 3 Na. NO3 3. Реагують з розчинами інших солей, якщо утворюється нерозчинна сіль:3 Ag. NO3 + Al. Cl3 = 3 Ag. Cl ↓ + Al(NO3) 3 Ba. SO4 ↓ + 2 HNO3 =Нітрати можна добути внаслідок дії нітратної кислоти на метали, основні оксиди, основи, амоніак і деякі солі, наприклад: Cu + 4 HN03 = Cu(N03)2 + 2 N02↑ + 2 Н20 Ca. O + 2 HN03 = Ca(N03)2 + H20 Mg(OH)2 + 2 HN03 = Mg(N03)2 + 2 H20 NH3 + HN03 = NH4 N03 Na2 C03 + 2 HN03 = 2 Na. N03 + C02↑+ H20
Застосування нітратів. Нітрати використовують переважно як добрива. Нітрати лужних металів використовують як компоненти ракетного палива. KNO3 використовують для виробництва чорного пороху. KNO3, Na. NO3 – у малих кількостях використовують для виробництва м’ясних продуктів, деяких сортів сиру (надають м’ясним продуктам червоно -коричневого кольору). Ag. NO3 – для виробництва дзеркал, в гальванотехніці, в аналітичній хімії, невеликі дози в медицині як в’яжучий і бактерицидний засіб. Ba(NO3)2, Sr(NO3)2, Pb(NO3)2 – у піротехніці.
3) Фізичні властивості солей амонію: Тверді кристалічні речовини, що за зовнішнім виглядом нагадують солі лужних металів. У воді добре розчиняються. Більшість солей амонію безбарвні. При взаємодії з сильними основами і нагріванні солі амонію легко розкладаються з утворенням амоніаку. У термічному відношенні солі амонію нестійкі і при нагріванні порівняно легко розкладаються. Кристалічні речовини з іонним типом зв'язку. До складу солей амонію входять один або кілька катіонів амонію і аніон кислотного залишку.
Хімічні властивості солей амонію: Солі амонію вступають у реакції йонного обміну:а) з лугами при нагріванні (якісна реакція на йон амонію NH4+). Аміак, що виділяється, розпізнають за запахом або за зміною кольору вологого лакмусового папірця: NH4 Cl + Na. OH = Na. Cl + NH3 ↑ + H2 Oб) деякі солі реагують з кислотами:(NH4) 2 CO3 + 2 HNO3 = 2 NH4 NO3 + CO2↑ + H2 Oв) з іншими солями: NH4 Cl + Ag. NO3 = NH4 NO3 +Ag. Cl ↓ 2. Термічний розклад солей амонію:а) якщо сіль амонію утворена кислотою -неокисником, то вона розкладається з утворенням NH3: NH4 Cl = NH3 ↑ + HCl ↑Це оборотна реакція; при нагріванні рівновага зміщується вправо, а на холоді — вліво:(NH4) 3 PO4 = 3 NH3 ↑ + HPO3 + H2 Oб) якщо кислота нелетка, то може бути часткове розкладання:(NH4) 2 SO4 = NH3 ↑ + NH4 HSO4в) якщо аніон кислоти виявляє окислювальні властивості, то відбувається необоротна реакція: NH4 NO2 = N2 ↑ + H2 O
Застосування солей амонію. Амоній нітрат (аміачна селітра) NH4 NО3, амоній сульфат (NH4)2 SО4, амоній дигідрогенортофосфат NH4 H2 PО4 та амоній гідрогенортофосфат (NH4)2 HPО4 є важливими мінеральними добривами. Амоній гідрогенкарбонат NH4 HCО3 (відомий під побутовою назвою амоняк) використовують як розпушувач тіста у кондитерському виробництві (Е 503). Амоній хлорид (нашатир) NH4 Cl застосовують у сухих гальванічних елементах.
4)Хімічні властивості ортофосфатів лужних і лужноземельних металічних елементів : Розчинні у воді ортофосфати виявляють загальні властивості солей. Розчинні солі взаємодіють з іншими солями за умови утворення осаду:2 K3 PO4 + 3 Ca. Cl2 = Ca3 (PO4) 2 + 6 KCl. Якісною реакцією на ортофосфат-іон є реакція розчину аргентум нітрату з розчинами солей ортофосфатної кислоти з утворенням жовтого осаду. Ag. NO3— реактив на ортофосфат-іон: Na3 PO4 + 3 Ag. NO3 = Ag. PO4 ↓ + 3 Na. NO32. Реагують з кислотами, утворюючи кислі солі: Ca3 (PO4) 2 + H3 PO4 = 3 Ca. HPO43. Розчинні у воді ортофосфати підлягають гідролізу: Na3 PO4 + 2 HOH = Na. H2 PO4 + 2 Na. OH (p. H > 7)4. Середні солі термічно стійкі, а кислі при нагріванні розкладаються з утворенням солей метафосфатної або пірофосфатної кислот: Na. H 2 PO 4 → Na. PO 3 + H 2 OCa(H 2 PO) 2 → Ca(PO 4) 2 + 2 H 2 O
Застосування ортофосватів лужних і лужноземельних металічних елементів : Виробництво фосфатних добрив, синтетичних мийних засобів1, харчова промисловість.1 Можуть містити до 40 % фосфатів (найчастіше пентанатрій трифосфат Nas. P3 O10), які пом’якшують воду, утворюючи комплексні сполуки з іонами Са2+ та Mg2+. У багатьох країнах використання фосфатів у мийних засобах заборонено.


про публікацію авторської розробки
Додати розробку