Урок: "Водневий хімічний зв'язок" 11 клас
Тема: Водневий хімічний зв'язок
Цілі уроку.
Сформувати знання про водневий зв'язок; визначити вплив водневого зв’язку на властивості речовин. Розглянути на основі будови молекул води і спиртів можливість утворення водневого зв’язку між молекулами води, спиртів, води та спиртів.
Розвивати вміння аналізувати інформацію, спостережливість, встановлювати причино-наслідкові зв’язки між властивостями і будовою речовин. Стисло й послідовно висловлювати думки.
Виховувати толерантне ставлення учнів один до одного, самостійність, доброзичливість, почуття відповідальності.
Тип уроку: комбінований.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, роздатковий матеріал планшети, комп’ютер, підручник, кольоровий кубик.
Використана література:
1. Н.В. Романова «Загальна та неорганічна хімія» - К.: Ірпінь: ВТФ «Перун», 2007. – 480 с.
2. Г. Є. Рудзітіс, Ф.Г. Фельдман «Хімія» підручник для 11 класу. К.: Освіта, 1993. – 173 с.
3. Хімія : довідник, М. В. Гриньова, Н.І. Шиян, Ю. П. Кращенко. – К.: Літера ЛТД, 2015. -464 с.
4. Білик О. М. Хімія. 7-9 класи. – Х.: Видавництво «Ранок», 2014. – 144 с.
Електронні носії:
1. https://learningapps.org/display?v=pbi68gpwn18
2. https://learningapps.org/2758411
3. http://present5.com/tema-ximichnij-zv-yazok-ta-budova-molekul-1-vidi/
|
Структур- ний елемент уроку. Поточна хвилина уроку. |
Діяльність учителя (викладання) |
Діяльність учня (учіння) |
Організація та управління навчально -пізнавальною діяльністю. |
|
І.Організа-ційний етап. 1-3 хв. |
1. Перевірка готовності обладнання до уроку. 2. Позитивне налаштування учнів до співпраці (прийоми «Кольоровий настрій», «Смайлик»)
|
1. Уразі потреби постановка запитань. 2. Самоперевірка готовності до уроку. |
1. Поради, нагадування щодо само- організації. 2. Створення настрою на урок. |
|
ІІ.Актуаліза-ція знань учнів. 1-8 хв. |
1. Візуальна перевірка дом. завдання. 2.Швидке тестування за допомогою вправ 1, 2 (додаток 1). 3. Обговорення результатів. 4. Питання: Чи відбудеться «розчинення» медведя? Чому? |
1. Чергові перевіряють наявність д/з. 2. За допомогою гаджетів виконують вправи на складання пазла та питання-відповідь. 3. Озвучення відповідей до вправ. 4. Обґрунтування відповіді до малюнку з «медведями». |
1. Стимулювання до самостійності учнів у прийнятті рішень. 2. Перевірити обізнаність учнів у попередньо вивченому матеріалі. |
|
ІІІ. Мотивація навчально – пізнаваль- ної діяль- ності. 2-5 хв. |
Постановка проблемних питань. 1. Чому радіатори опалення наповнюють водою? 2. Більшість органічних сполук погано розчинні в воді, але є такі які безмежно розчинні: етиловий спирт, оцтова кислота. Чому? |
Висловлювання власних міркувань. |
Активізація пізнавальної діяльності. |
|
ІV. Повідом-лення теми, мети і планування уроку. 1-2 хв. |
Повідомлення теми й мети уроку. Ознайомлення з планом роботи на уроці. Інструкція щодо використання інформаційної картки. |
Записують тему, число в робочий зошит. |
Зосередження уваги на новій темі та її значимості. |
|
V. Вивчення нового матеріалу. 15 хв. |
1. Високі температури кипіння спиртів, води, зменшення густини льоду є наслідком утворення водневого зв'язку. Виникає питання чому саме Гідроген здатний утворювати такі специфічні зв’язки? Вчитель пропонує прочитати текст, обговорити його в парі, та дати обґрунтовану відповідь питання. (додаток 2).
|
1. Записують визначення водневого зв’язку за карткою. 2. Читають текст, записують інформацію, обговорюють в парах. Формують відповіді
|
Стимулювання учнів до слухового та зорового зосередження. Контроль діяльності. |
|
VI. Закріплення вивченого матеріалу. 4-5 хв. |
Повернення до проблемних питань (евристична бесіда). Тест «Що я запам’ятав ?» (додаток 3). |
Аргументація відповідей |
Учні засвоюють причино – наслідкові зв’язки між властивостями речовини та її будовою. |
|
VIІ.Підсумок уроку. Рефлексія 3-5 хв. |
Підсумок за тестом. Вправа «Закінчи речення» |
1.Самооцінюваня навчально - пізнавальної діяльності на уроці за тестом. 2. Учні завершують речення: Я дізнався що…. Я розумію тепер…. Я не зрозумів …. Я хотів би більше дізнатись …. |
Виставлення оцінок за роботу на уроці. |
|
VIІІ. Домашнє завдання 1-2 хв.
|
1. Знайдіть інформацію щодо впливу водневого зв'язку на фізичні властивості речовин та його роль у біологічних системах. 2. Представлення результатів навчального проекту «Значення водневого зв’язку для організації структури біополімерів». 3. Підготуватись до поточного тестування з теми «Хімічні зв’язки» |
Записують домашні завдання, ставлять уточнюючі питання. |
Консультування учнів за їх потребою. |
(Додаток 1)

 ВОДНЕВИЙ ЗВ'ЯЗОК
ВОДНЕВИЙ ЗВ'ЯЗОК
Водневий зв'язок – це зв’язок між атомом Гідрогену, що з’єднаний з атомом більш електронегативного елемента однієї молекули та сильно електронегативними
Вправа 1 атомами ( F, O, N) іншої молекули. Вправа 2
 Цей зв'язок у 15-20 разів слабкіший, ніж ковалентний.
Цей зв'язок у 15-20 разів слабкіший, ніж ковалентний.
Водневий зв'язок впливає на фізичні властивості речовин –
підвищуються температури плавлення й кипіння, зменшується
густина. Це пов’язано з тим, що потрібна додаткова енергія для
розриву водневого зв’язку.
Водневі зв’язки довші і тому слабкіші від ковалентних (20 кДж/моль у льоду, що становить лише 4,3% енергії ковалентного зв’язку Н–О, а довжина його 1,8∙10-12 м, вдвічі більша від Н–О).
Утворення водневих зв’язків відіграє важливу роль у процесах, які відбуваються при звичайній температурі. Вони підтримують вторинну структуру білків, нуклеїнових кислот. Завдяки водневим зв’язкам лід (кристалічна вода) легший за рідку воду, через що утворюється на поверхні і захищає рідину від втрати тепла.
Д. І. Менделєєв вивчав процеси розчинення спирту у воді. Він дійшов висновку, що при розчиненні відбувається хімічний процес взаємодії молекул спирту з молекулами води.
Водневий зв'язок позначається крапками ….
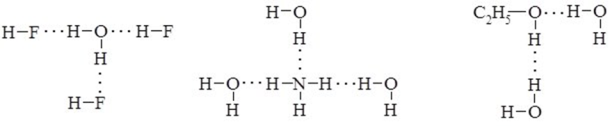
Схематичне зображення водневого зв’язку



Види водневого зв’язку



Поняття про водневий зв'язок (Додаток 2)
Водневий зв'язок пояснюється здатністю атома Гідрогену, сполученого в атомом сильно електронегативного елемента (F, О, N, Сl, S, В тощо), утворювати ще один хімічний зв'язок в електронегативним елементом.
Утворення водневого зв'язку зумовлено дуже малим розміром досить поляризованого атома Гідрогену у сполуці. При утворенні полярного ковалентного зв'язку між атомом Гідрогену та атомом з високою електронегативністю електронна хмара сильно зміщується до атома електронегативного елемента. В результаті цей атом набуває значного ефективного негативного заряду, а ядро атома Гідрогену (протон) майже втрачає електронну хмару.
Між протоном Гідрогену і негативно зарядженим атомом іншої молекули виникає електростатична взаємодія, яка зумовлює утворення водневого зв'язку. З позиції методу валентних зв'язків ковалентний зв'язок є двоцентровим зв'язком, а водневий – трицентровим (одна електронна орбіталь Гідрогену забезпечуе зв'язок між трьома атомами). У графічних формулах водневий зв'язок позначається трьома крапками.
Енергія водневого зв'язку становить 8–40кДж/моль і за міцністю дещо перевищує енергію вандерваальсівської взаємодії, проте набагато менша за енергію ковалентного зв'язку. Енергія водневого зв'язку зменшується із збільшенням температури. Тому водневий зв'язок більш характерний для речовин у рідкому і твердому станах.
Водневий зв'язок відіграє важливу роль при асоціації молекул, кристалізації, розчиненні, утворенні кристалогідратів, електролітичній дисоціації; в хімії органічних сполук, полімерів, білків. Водневий зв'язок виявляється у неорганічних і органічних сполуках (спирти, кислоти, вуглеводні тощо). Розрізняють водневий зв'язок міжмолекулярний, внутрішньомолекулярний і міжатомний.
Пригадаємо електронну будову молекули води, яку ми розглянули ще у 8 класі: під час утворення молекули води між атомами Оксигену й Гідрогену утворюються дві спільні електронні пари, які зумовлюють ковалентний зв’язок у молекулі води. При цьому в атома Оксигену ще залишаються дві неподілені електронні пари:
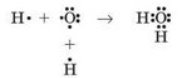
Ці електронні пари утворюють підвищену електронну густину навколо атома Оксигену й дозволяють йому взаємодіяти з іншими частинками (йонами або молекулами), у яких «дефіцит» електронної густини. У молекулі води зв’язок між атомом Гідрогену й Оксигену дуже полярний, тобто спільні електронні пари значно зміщені в бік атома Оксигену. Завдяки цьому на атомах Гідрогену відчувається «дефіцит» електронів і виникає певний позитивний заряд.
Отже, між атомом Оксигену однієї молекули води та атомом Гідрогену іншої молекули виникає додаткова взаємодія:
![]()
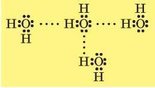
Атоми Гідрогену й Оксигену в молекулі води утворюють водневі зв'язки із сусідніми молекулами.
Таку взаємодію називають водневим зв’язком і позначають рядом крапок. Цей зв’язок не такий міцний, як ковалентний, але достатній, щоб утримувати молекули води разом на певній відстані.
Водневий зв'язок - це взаємодія атома Гідрогену, сполученого з електронегативним атомом (Оксигену, Нітрогену або Флуору), однієї молекули зі значно електронегативним атомом іншої молекули.
Завдяки утворенню водневих зв’язків молекули об’єднуються в асоціати. Так, HF існує у вигляді асоціатів (HF)n, де n = 2 ¸ 6. Водневі зв’язки сильно змінюють фізичні властивості. Вода за їх відсутності мала б кипіти при – 66 0С.
Водневі зв’язки можуть виникати між однаковими або різними молекулами неорганічних (HF, H2O, NH3) та органічних (спиртів, кислот та їх водних розчинів) речовин:

Вплив водневого зв'язку на фізичні властивості речовин.
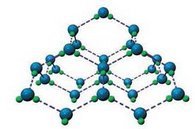
У воді атом Оксигену завдяки двом неподіленим електронним парам утворює зв’язки з атомами Гідрогену двох сусідніх молекул води. У свою чергу атоми Гідрогену цієї молекули утворюють зв’язки з атомами Оксигену інших молекул води. У такий спосіб кожна молекула води може утворити по чотири водневі зв’язки з іншими молекулами води. Це зумовлює специфічні властивості води: у твердому стані густина льоду менша порівняно з рідкою водою, тому під час замерзання вода розширюється .
Кристалічні ґратки твердої води: кожна молекула утворює по чотири водневі зв'язки із сусідніми молекулами
Завдяки додатковому зв’язуванню молекул водневими зв’язками вода виявляє певні аномальні фізичні властивості. Так, молекулярні речовини з невеликими молекулярними масами характеризуються низькими температурами кипіння та плавлення. Але завдяки водневим зв’язкам у води аномальна висока температура кипіння
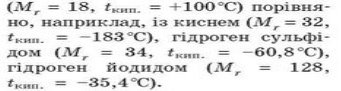
Серед цих речовин у води молекули найлегші, а температура кипіння - найбільша, оскільки на руйнування додаткової взаємодії потрібна додаткова енергія (додаткове нагрівання). Наявність водневих зв’язків зумовлює великий поверхневий натяг води, завдяки чому багато комах здатні переміщатися по воді.
Можливістю утворення водневих зв’язків з молекулами інших речовин, що також здатні утворювати такі зв’язки, пояснюється добра розчинність багатьох речовин у воді: спирту, цукру, ацетону, оцтової кислоти тощо.
Наявність додаткового зв’язування молекул водневими зв’язками також зумовлює аномально високу теплоємність води: щоб пришвидшити тепловий рух, молекулам необхідно надати значно більше теплоти. Така особливість води має велике значення для формування клімату на Землі. Поблизу морів та океанів клімат м’якіший, ніж у центрі континентів.
Водневий зв’язок можуть утворювати не тільки молекули води, а й молекули інших речовин: неорганічних (гідроген флуориду HF, амоніаку NH3 тощо) та органічних (етилового спирту, ацетону, оцтової кислоти тощо), що зумовлює їхню добру розчинність у воді.
Завдяки водневим зв’язкам молекули білків та нуклеїнових кислот мають спіральну будову.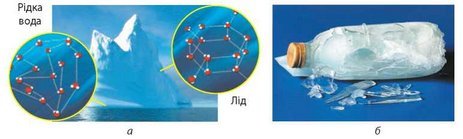
У рідкій воді молекули води розташовані невпорядковано та близько одна до одної; у льоду молекули розташовані впорядковано й на більшій відстані, тому лід легший за воду (а). Під час замерзання вода розширюється, внаслідок чого закрита скляна пляшка з водою в морозилці лопається (б)
(Додаток 3)
Тестування «Що я запам’ятав ?»
1. Визнач помилкове твердження:
А. Водневий зв'язок – це зв’язок між атомом Гідрогену, що з’єднаний з атомом менш електронегативного
елемента однієї молекули та сильно електронегативними атомами ( F, O, N) іншої молекули.
Б. Завдяки утворенню водневих зв’язків молекули об’єднуються в асоціати.
В. Атоми Гідрогену й Оксигену в молекулі води утворюють водневі зв'язки із сусідніми молекулами.
2. Водневий зв'язок сприяє:
А. Підвищенню температури кипіння спирту.
Б. Зниженню температури кипіння води.
В. Підвищенню хімічної активності води.
3. У радіатори опалення заливають воду так як вона:
А. Легко нагрівається.
Б. Має високу теплоємність.
В. Хімічно пасивна речовина.
4. Як впливає водневий зв'язок на швидкість хімічної реакції ?
А. Прискорює хімічну реакцію
Б. Сповільнює хімічну реакцію
В. Не впливає на швидкість хімічної реакції
5.Чому саме Гідроген приймає участь в утворені водневого зв’язку?
А. Атом Гідрогену має дуже малий радіус і при віддачі електрона стає сильно поляризованим.
Б. Атом Гідрогену найлегший.
В. Атома Гідрогену не має протонів.
6. Спирти, карбонові кислоти добре розчиняються у воді завдяки:
А. Утворенню між молекулами ковалентних полярних зв’язків.
Б. Утворенню між молекулами водневих зв’язків.
В. Дифузії.
7. Чи руйнується водневий зв'язок при нагріванні?
А. Так
Б. Ні
В. Ваша відповідь.
8. Максимальну густину вода має за температури:
А. 4°С
Б. 0 °С
В. +18 °С
9. Водневий зв'язок утворюється між речовинами:
А. С2Н2 і Н2О
Б. Н2О і NH3
В. Cl2 і F2
10. Яка структура білка утворюється за рахунок водневого зв’язку?
А. Первинна
Б. Вторинна
В. Четвертинна.
11. Чи існує зв'язок між формуванням клімату на нашій планеті й водневим зв’язком.
12. Замалюйте схеми утворення водневого зв’язку між молекулами води; спирту і води; спирту.



про публікацію авторської розробки
Додати розробку