Презентація "Закон Авогадро, Молярний об*єм"
Про матеріал
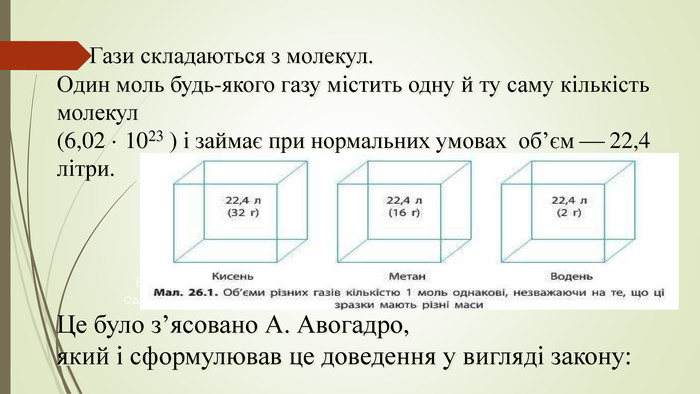
Презентація до уроку "Молярний об'єм, Закон Авогадро", містить приклади задач на молярний об'єм та короткий опис закону Авогадро Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Дякую, за підібрані задачі
-
Дякую за матеріал!
-
дякую за матеріал, саме те, що шукала.


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку