Презентація "Збуджений стан атома. Валентність. Ступінь окиснення елементів "


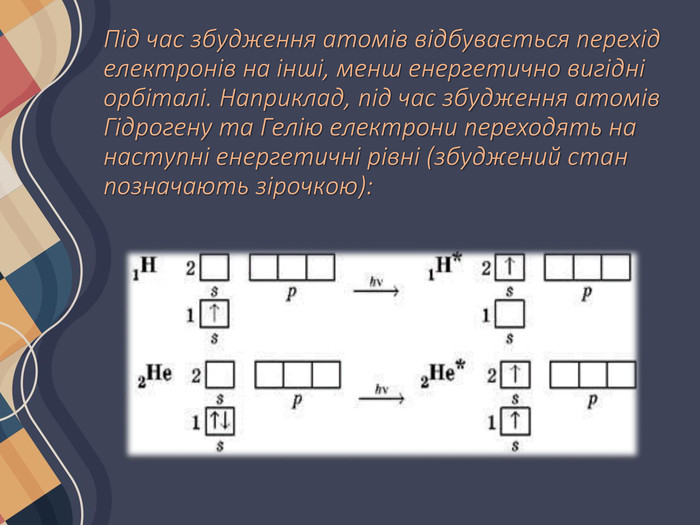












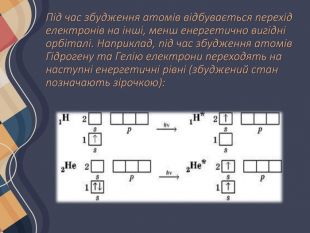
Збуджений стан атома Зазвичай, коли ми говоримо про атоми чи молекули, йдеться про їхній основний енергетичний стан. Основним називають такий стан атома (молекули), у якому енергія атома (молекули) мінімальна. У більшості випадків ця енергія визначається розподілом електронів в електронній оболонці атома згідно з принципом мінімальної енергії. Будь-який енергетичний стан, що відрізняється від основного, називають збудженим. У такий стан атоми (молекули) можуть переходити за певних умов: під час нагрівання, за умови поглинання електромагнітного випромінювання (видимого, ультрафіолетового тощо).
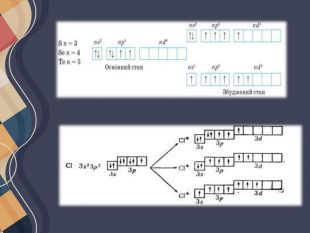
Для таких електронних переходів потрібно дуже багато енергії. Приміром, для збудження атомів Гідрогену їх необхідно опромінити жорстким ультрафіолетовим випромінюванням (так званий вакуумний ультрафіолет) або нагріти приблизно до температури 35 000 К (температура поверхні Сонця 6000 К). Різниця енергій орбіталей на одному енергетичному рівні набагато менша, тому атоми всіх інших неметалічних елементів переходять у збуджений стан набагато легше, для цього необхідна енергія, яку можна порівняти з енергією хімічних реакцій.
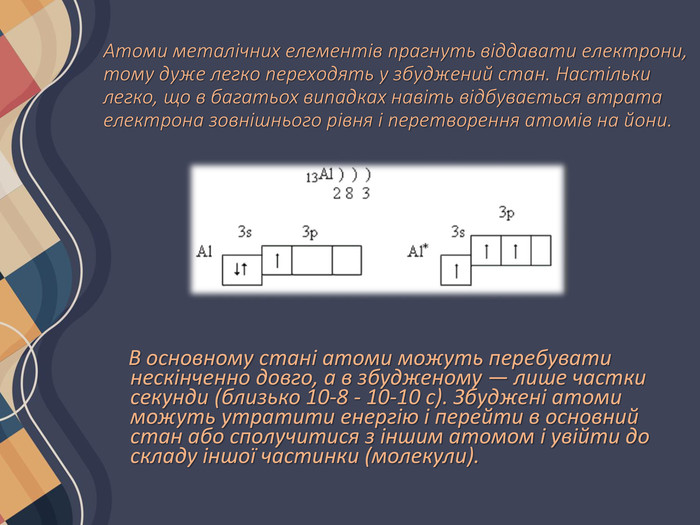
Атоми металічних елементів прагнуть віддавати електрони, тому дуже легко переходять у збуджений стан. Настільки легко, що в багатьох випадках навіть відбувається втрата електрона зовнішнього рівня і перетворення атомів на йони. В основному стані атоми можуть перебувати нескінченно довго, а в збудженому — лише частки секунди (близько 10-8 - 10-10 с). Збуджені атоми можуть утратити енергію і перейти в основний стан або сполучитися з іншим атомом і увійти до складу іншої частинки (молекули).
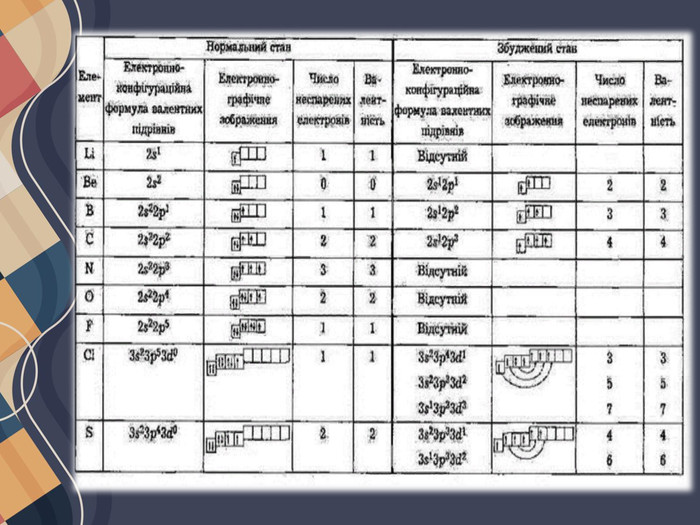
Валентні стани елементів Валентністю називають число хімічних зв'язків, які атом утворює з іншими атомами в молекулі, тобто валентність дорівнює числу спільних електронних пар, утворених атомом. Але спільні електронні пари характерні тільки для ковалентного зв'язку, тому про валентність атомів коректно говорити лише щодо ковалентних сполук.
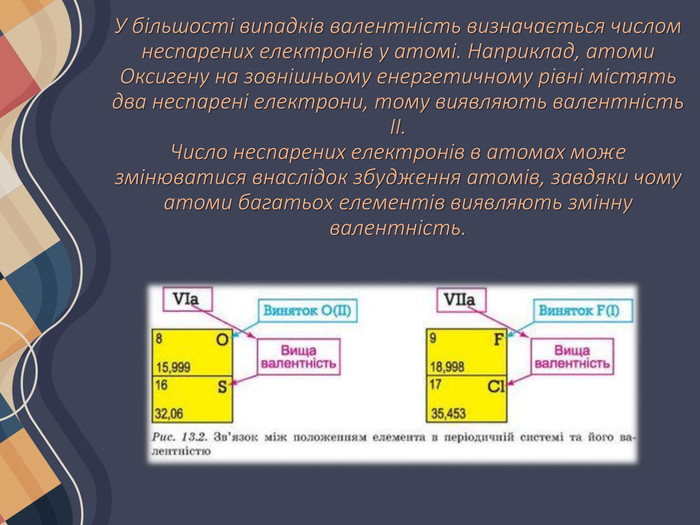
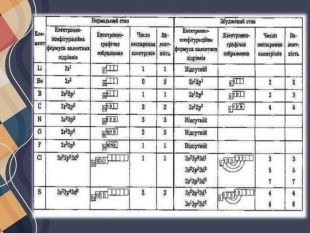
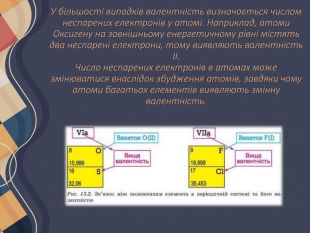
У більшості випадків валентність визначається числом неспарених електронів у атомі. Наприклад, атоми Оксигену на зовнішньому енергетичному рівні містять два неспарені електрони, тому виявляють валентність II. Число неспарених електронів в атомах може змінюватися внаслідок збудження атомів, завдяки чому атоми багатьох елементів виявляють змінну валентність.
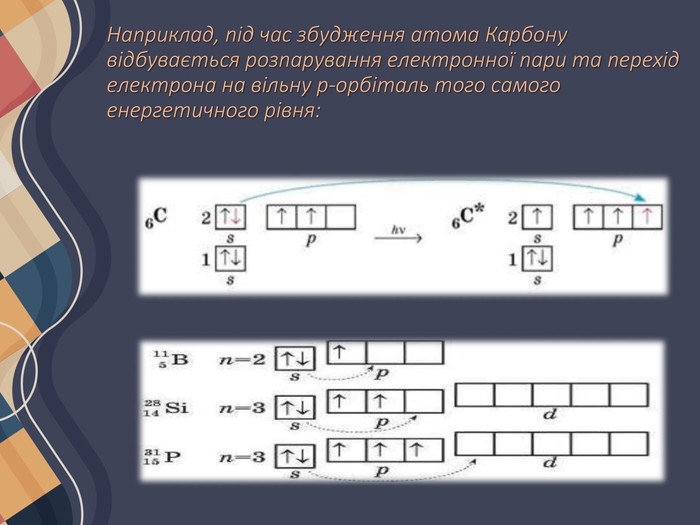
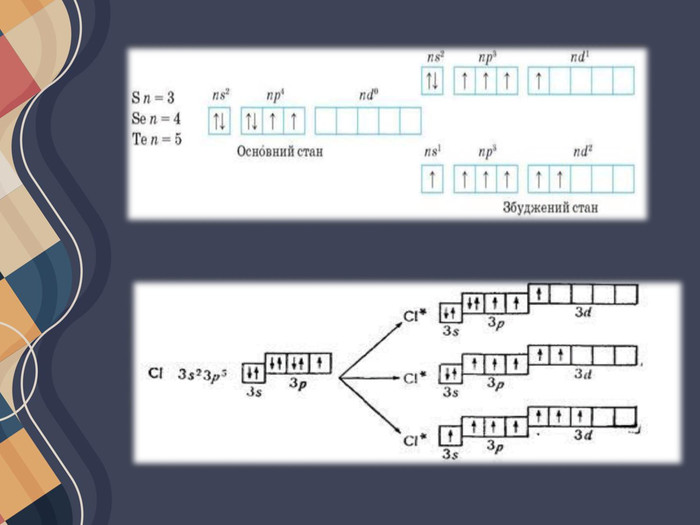
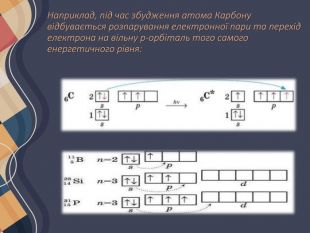
Атом Хлору в основному стані на зовнішньому рівні містить один неспарений електрон, за допомогою якого він утворює один хімічний зв'язок, отже, виявляє валентність I. Поглинаючи енергію, одна з електронних пар розпаровується: Унаслідок цього в атомі Хлору є вже три неспарені електрони, отже, він виявляє валентність III. Але і в цьому випадку на зовнішньому енергетичному рівні атома Хлору залишаються дві електронні пари і вільні d-орбіталі. Тому за умови поглинання додаткової енергії можливий перехід інших електронів на вільні орбіталі, завдяки чому Хлор може виявляти валентність V, а також і свою вищу валентність — VII. Таким чином можна визначити всі можливі валентності для більшості елементів . Слід зауважити, що на зовнішньому енергетичному рівні атомів Нітрогену, Оксигену та Флуору вільні орбіталі відсутні, тому збільшення числа неспарених електронів для них неможливе.
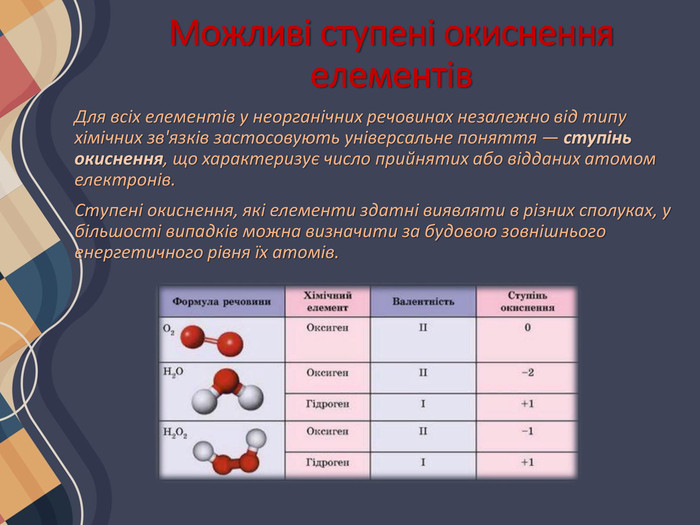
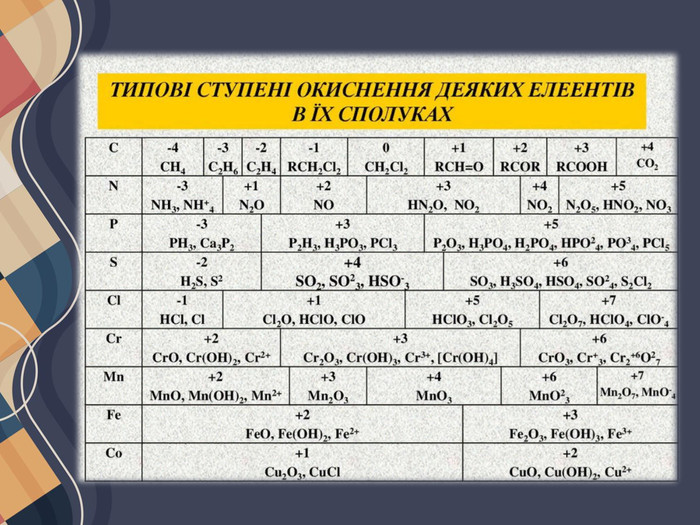
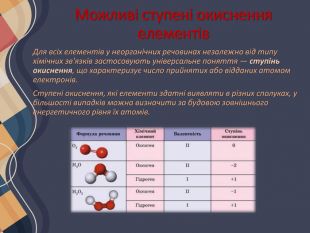
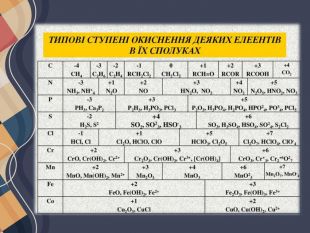
Можливі ступені окиснення елементів. Для всіх елементів у неорганічних речовинах незалежно від типу хімічних зв'язків застосовують універсальне поняття — ступінь окиснення, що характеризує число прийнятих або відданих атомом електронів. Ступені окиснення, які елементи здатні виявляти в різних сполуках, у більшості випадків можна визначити за будовою зовнішнього енергетичного рівня їх атомів.
Атоми металічних елементів тільки віддають електрони, тому в сполуках вони виявляють позитивний ступінь окиснення. Його значення в багатьох випадках (за винятком d-елементів) дорівнює числу електронів на зовнішньому рівні, а отже, і номеру групи в Періодичній системі (короткому варіанті).
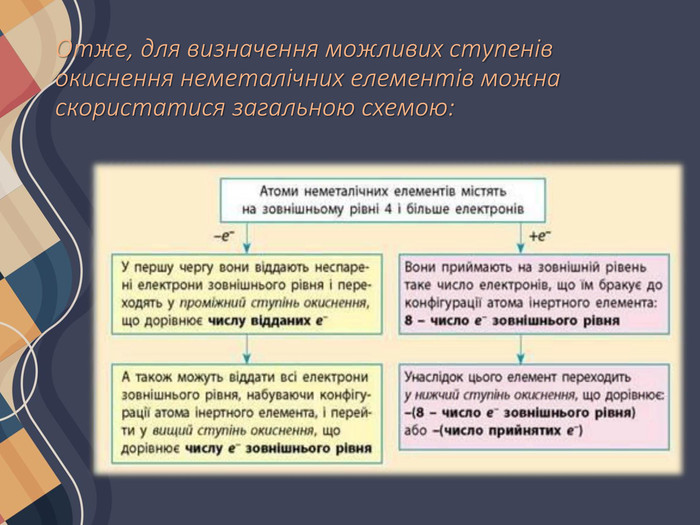
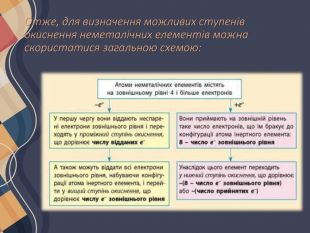
Атоми неметалічних елементів можуть виявляти як позитивний, так і негативний ступінь окиснення залежно від того, з атомом якого елемента вони утворюють зв'язок. Якщо елемент більш електронегативний, то його атоми приймають електрони від інших атомів, і він виявляє негативний ступінь окиснення, і навпаки. Ступені окиснення неметалічних елементів у разі прийому електронів Атоми неметалічних елементів на зовнішньому енергетичному рівні містять 4 і більше електронів, тому вони насамперед прагнуть прийняти електрони на зовнішній рівень, щоб здобути електронну конфігурацію атома інертного елемента. Наприклад, у атома Флуору на зовнішньому рівні 7 електронів, він може прийняти до октету тільки 1 електрон, унаслідок чого він переходить у ступінь окиснення -1, що є нижчим для Флуору:
Оскільки число електронів на зовнішньому рівні збігається з номером групи (короткого варіанта ПС), то вищий ступінь окиснення неметалічних елементів дорівнює номеру групи (за винятком Флуору та Оксигену). Певна річ, для всякого правила є винятки, але в розглянутий спосіб можна визначити майже всі можливі ступені окиснення для будь-яких s- та p-елементів:


про публікацію авторської розробки
Додати розробку
















-

фертак наталя
05.09.2025 в 22:51
дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Грищенко Ирина
09.09.2024 в 20:32
дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Мигаленко Тетяна
18.09.2023 в 16:32
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Дешко Вита
27.01.2023 в 10:45
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Міркевич Ірина Олександрівна
26.09.2022 в 22:05
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 2 відгука