Природа хімічного зв’язку. Електронегативність атомів хімічних елементів
План-конспект уроку
на тему:
«Природа хімічного зв’язку. Електронегативність атомів хімічних елементів»
Мета: освітня: повторити відомості про електронну будову елементів малих періодів, залежність властивостей елементів від кількості валентних електронів. Дати учням поняття про електронегативність і на його основі розкрити єдність металічних і неметалічних властивостей елементів, показати залежність характеру хімічних зв’язків від електронегативності елементів, що утворюють дану сполуку.
розвиваюча: розвивати вміння знаходити логічні зв’язки між поняттями, розвивати культуру хімічної мови, інтелектуальні здібності, робити висновки;
виховна: виховувати вміння працювати в колективі, повагу один до одного.
Тип уроку – вивчення нового матеріалу.
Методи і методичні прийоми:
1. пояснювально-ілюстративний;
2. частково-пошуковий (постановка проблемного питання);
3. пояснення;
4. бесіда;
5. інтерактивні;
6. релаксопедичний.
Обладнання: таблиця електронегативності атомів хімічних елементів Полінга, періодична система хімічних елементів Д.І. Менделєєва, роздатковий матеріал (завдання для роботи на уроці).
Основні поняття та терміни: електронегативність атомів хімічних елементів, хімічний зв'язок.
Хід уроку
І. Організаційний етап.
Привітання, перевірка присутніх учнів у класі та наявності у них необхідного обладнання.
Створення позитивної атмосфери для вивчення нової теми.
Народна мудрість говорить: «ніхто не знає так багато, як ми всі разом!».
ІІ. Актуалізація опорних знань та вмінь учнів.
Ми закінчили вивчати ПСХЕ Д.І.Менделєєва і ви вже знаєте, що за положенням будь-якого елемента в ПС можна дізнатись про його будову і властивості.
1. Користуючись даними ПС пропоную визначити кількість р+, е-, n0 у складі атомів таких хімічних елементів:
11Na 13Al 16S 18Ar.
2. Що називають валентністю атомів хімічних елементів? (це кількість неспарених електронів).
3. Чому чисельно дорівнює валентність атомів хімічних елементів? (номеру групи, саме з наявністю збудженого стану атомів пов’язане існування елементів зі змінною валентністю).
4. Користуючись даними ПС пропоную зобразити електронні конфігурації таких атомів хімічних елементів:
11Na 13Al 16S 18Ar.
5. Користуючись графічними формулами дайте відповідь на запитання:
- Чи завершені зовнішні енергетичні рівні у запропонованих атомів хімічних елементів?
- Назвіть елементи малих періодів у яких зовнішній енергетичний рівень завершений?
- Чи можуть атоми хімічних елементів існувати як самостійні частинки? (так, інертні елементи, оскільки мають завершений зовнішній енергетичний рівень).
- А як же з’єднуються атоми інших хімічних елементів у певні сполуки?
ІІІ. Мотивація навчальної діяльності.
Отже, ті хімічні елементи, які мають незавершений зовнішній енергетичний
рівень хімічно активні і зустрічаючись з іншими хімічними елементами утворюють прості і складні речовини завдяки утворенню хімічних зв’язків.
Для того, щоб зрозуміти як утворюються речовини ми вивчимо тему: „Хімічний зв’язок і будова речовини”.
Вивчаючи тему ви ознайомитесь з такими поняттями, як хімічний зв’язок, кристалічна решітка, валентність і ступінь окислення; навчитесь визначати типи хімічних зв’язків, типи кристалічних решіток і складати рівняння окисно-відновних реакцій.
ІV. Вивчення нового матеріалу.
Атоми різних елементів, що входять до складу простих і складних хімічних речовин утримуються завдяки наявності хімічного зв’язку.
Хімічний зв'язок – це зв’язок між атомами чи будь-якими частинками, шляхом перекривання зовнішніх енергетичних рівнів, внаслідок чого утворюється молекула або формульна одиниця кристалу.
Хімічні зв'язки є результатом взаємодії електронів та ядер атомів і описуються квантовою механікою.
В першій третині XX ст. зародилася окрема галузь хімії, предметом якої є вивчення структури молекул і кристалів за допомогою квантово-механічних розрахунків: квантова хімія. Ця галузь набула особливо інтенсивного розвитку протягом кількох останніх десятиріч.
В утворенні хімічного зв’язку беруть участь:
Кулонівські сили
(виникають між будь-якими протилежно зарядженими частинками)
/ \
притягання відштовхування
+ e- + +
(одного атома) (іншого атома) (одного атома) (іншого атома)
(сили притягання і відштовхування урівнюються, енергія найменша,
тобто виникає хімічний зв’язок, утворюється молекула).
Отже, ЗАПАМЯТАЙ!!! Хімічний зв’язок є наслідком електростатичної взаємодії негативно заряджених електронів і позитивно заряджених ядер.
Фізкультхвилинка. Пригадайте, у дитячому садочку, у початковій школі, ви водили хороводи на новорічні свята навколо ялинки. Якщо вас було мало, як ви розташовували свої руки? А якщо вас було багато? Кожен з вас намагався наблизитися до ялинки!!! Уявіть, що ялинка – це ядро атома, а ви – електрони. Давайте зробимо висновок: на якій відстані розташовуються електрони до ядра? (прагнуть наблизитися). Відстань від центру ядра до зовнішніх електронів – це і є радіус атома.
Чим більший радіус ядра атома, тим далі від ядра розташовуються електрони.
У якого з елементів ІІІ періоду електрони розташовані найближче до ядра?
У якого з елементів ІІ А групи електрони розташовані найближче до ядра?
Які можливі випадки об’єднання елементів з утворенням простих (складних) речовин?
1) Об’єднуються атоми неметалічних елементів з однаковим значенням електронегативності;
2) Об’єднуються атоми неметалічних елементів з різним значенням електронегативності;
3) Об’єднуються атоми металічних та неметалічних елементів, які різко відрізняються за значенням електронегативності.
Металічні елементи легко віддають валентні електрони, оскільки їх мало (від 1 до 3), а неметалічні елементи на зовнішньому шарі містять від 4 до 8 електронів, тому здатні притягувати до себе електрони. Цю властивість називають електронегативністю.
Електронегативність елемента – це здатність його атома притягувати до себе електронну густину (електрони) атомів інших хімічних елементів.
|
ПОЧАТОК ПЕРІОДА |
≈ СЕРЕДИНА ПЕРІОДА |
КІНЕЦЬ ПЕРІОДА |
|
↓ |
↓ |
↓ |
|
Елементи, атоми яких віддають електрони (від 1-2) |
Елементи, атоми яких складніше віддають електрони (2-3) |
Елементи, атоми яких приєднують електрони |
|
↓ |
↓ |
↓ |
|
Елементи з сильно вираженими металічними властивостями |
Амфотерні елементи, оксиди й гідроксиди яких виявляють амфотерні властивості |
Елементи з чітко вираженими неметаліч-ними властивостями |
|
Н-д: Li, Na, Mg |
Н-д: Be, Al |
Н-д: N, P, S, Cl |
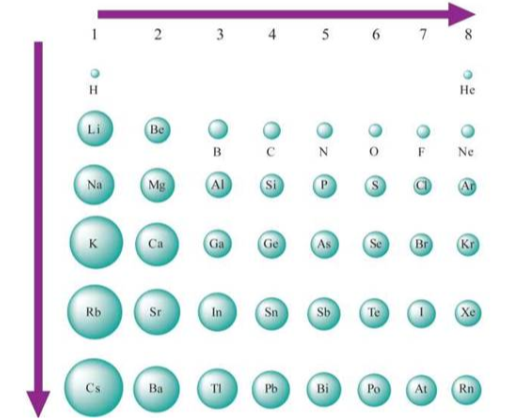
Існує шкала електронегативності атомів хімічних елементів. Вперше її розробив американський хімік Лайнус Полінг (1932 рік). Він виявив загальну тенденцію зміни електронегативностей елементів у періодичній системі.
У періодах електронегативність елементів зростає зліва на право, а групах – знизу вгору.
V. Узагальнення та систематизація знань.
1. Що називають хімічним зв’язком?
2. Що називають електронегативністю?
3. Який внесок Полінга у вивчення електронегативності атомів хімічних елементів?
4. Як змінюється електронегативність атомів хімічних елементів у межах періода? В межах групи?
Розмістити елементи в порядку зростання електронегативності атомів хімічних елементів:
а) F, Na, C, N;
б) S, K, O, Li;
в) Br, I, Se, Rb.
VІ. Підведення підсумків уроку.
Що на сьогоднішньому уроці було не зрозумілим?
Які враження від сьогоднішнього уроку?
Що нового для себе дізналися під час уроку?
VІІ. Надання та пояснення домашнього завдання.
Актуалізація опорних знань та умінь учнів
- Користуючись даними періодичної системи визначте кількість р+, е-, n0 у складі атомів таких хімічних елементів:
|
|
11Na |
13Al |
16S |
18Ar |
|
р+ |
|
|
|
|
|
е- |
|
|
|
|
|
n0 |
|
|
|
|
- Зобразіть електронні конфігурацій (графічні формули) атомів таких хімічних елементів:
11Na 13Al 16S 18Ar.
ПАМЯТАЙТЕ! Усі атоми прагнуть завершити свій зовнішній енергетичний рівень!!!
3. Користуючись графічними формулами дайте відповідь на запитання:
а) чи завершені зовнішні енергетичні рівні у запропонованих атомів хімічних елементів?
б) назвіть елементи малих періодів у яких зовнішній енергетичний рівень завершений?
в) чи можуть атоми хімічних елементів існувати як самостійні частинки?
г) як з’єднуються атоми інших хімічних елементів у певні сполуки?
Атоми різних елементів, що входять до складу простих і складних хімічних речовин утримуються завдяки наявності хімічного зв’язку.
Хімічний зв'язок – це зв’язок між атомами чи будь-якими частинками, шляхом перекривання зовнішніх енергетичних рівнів, внаслідок чого утворюється молекула або формульна одиниця кристалу. В утворенні хімічного зв’язку беруть участь:
кулонівські сили
(виникають між будь-якими зарядами атомів)
↓ ↓
притягання відштовхування
+ e- + +
(одного атома) (іншого атома) (одного атома) (іншого атома)
(сили притягання і відштовхування урівнюються, тобто виникає хімічний зв’язок, наприклад, утворюється молекула).
Чим більший радіус ядра атома, тим далі від ядра розташовані електрони.
4. У якого з елементів ІІІ періоду електрони розташовані найближче до ядра?
5. У якого з елементів ІІ А групи електрони розташовані найближче до ядра?
|
ПОЧАТОК ПЕРІОДА |
≈ СЕРЕДИНА ПЕРІОДА |
КІНЕЦЬ ПЕРІОДА |
|
↓ |
↓ |
↓ |
|
Елементи, атоми яких віддають електрони (від 1-2) |
Елементи, атоми яких складніше віддають електрони (2-3) |
Елементи, атоми яких приєднують електрони |
|
↓ |
↓ |
↓ |
|
Елементи з сильно вираженими металічними властивостями |
Амфотерні елементи, оксиди й гідроксиди яких виявляють амфотерні властивості |
Елементи з чітко вираженими неметалічними власти-востями |
|
Н-д: Li, Na, Mg |
Н-д: Be, Al |
Н-д: N, P, S, Cl |
Електронегативність елемента – це здатність його атома притягувати до себе електронну густину (електрони) атомів інших хімічних елементів.
У періодах електронегативність атомів хімічних елементів зростає зліва на право, а групах – знизу вгору.
6. Використовуючи вивчений матеріал розмістіть елементи Нітроген, Оксиген, Натрій, Хлор, Фосфор, Літій в порядку зростання їх електронегативності.
 Зміна радіусів атомів хімічних елементів
Зміна радіусів атомів хімічних елементів
Шкала електронегативності атомів хімічних елементів
Лайнуса Полінга (1932 рік)
|
Група |
І |
ІІ |
ІІІ |
ІV |
V |
VI |
VII |
VIII |
|
Період |
||||||||
|
1 |
(Н) |
|
|
|
|
|
Н 2,1
|
|
|
2 |
Li 1,0
|
Be 1,5 |
B 2,0 |
C 2,5 |
N 3,0 |
O 3,5 |
F 4,0 |
|
|
3 |
Na 0,9
|
Mg 1,2 |
Al 1,5 |
Si 1,8 |
P 2,2 |
S 2,5 |
Cl 3,0 |
|
|
4 |
K 0,8
|
Ca 1,0 |
|
|
|
|
Br 2,8 |
|
Американський хімік Лайнус Карл Полінг (1901-1994)
у 1954 році отримав Нобілевську премію з хімії
а у 1962 році Нобілевську премію миру.
Полінг був активним противником проведення випробувань ядерної зброї.



про публікацію авторської розробки
Додати розробку
