Прості та складні речовини(теорія)
Хімія 7 клас
Прості та складні речовини
План:
- Прості речовини
- Складні речовини
- Усі хімічні речовини поділяються на прості і складні.
Простими називаються речовини, утворені атомами одного хімічного елемента.
Деякі прості речовини складаються з молекул.
Одноатомні молекули утворюють інертні гази гелій He, неон Ne, аргон Ar та інші.
З двохатомних молекул складаються водень H2, кисень O2, азот N2, галогени F2, Cl2, Br2, I2.
Три атоми — у молекулах озону O3, чотири — у молекулах білого фосфору P4, вісім — у молекулах сірки S8.

Моделі молекул водню і азоту

Модель молекули білого фосфору
Інша група простих речовин має немолекулярну будову. До таких речовин відносяться усі метали, а також червоний фосфор, алмаз, графіт, силіцій та інші.
Їх хімічні формули записують хімічним символом елемента без індексу: Fe, P, C, Si, тощо.
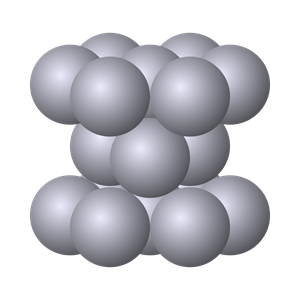
Модель кристалу заліза
Алотропія
Відомо 118 хімічних елементів, а простих речовин — більше, ніж 400. Один хімічний елемент може утворити кілька простих речовин.
Явище існування декількох простих речовин, утворених атомами одного хімічного елемента, називається алотропією.
Прості речовини, що складаються з атомів одного хімічного елемента — алотропні модифікації (алотропні видозміни).
Приклад:
хімічний елемент Оксиген утворює прості речовини, що відрізняються складом молекул: кисень O2 і озон O3. Кисень — газ без запаху, він є необхідним живим організмам для дихання. Озон має запах, отруйний.
Хімічний елемент Фосфор утворює молекулярну речовину — білий фосфор P4 і немолекулярну — червоний фосфор P. Ці речовини відрізняються не лише будовою, а й властивостями. Білий фосфор має запах, самозаймається на повітрі. Червоний фосфор без запаху, горить лише при нагріванні.
Хімічний елемент Карбон утворює немолекулярні речовини алмаз і графіт. Вони позначаються однаковою формулою — C, але мають різну будову і відрізняються властивостями. Алмаз є прозорою, безбарвною, дуже твердою речовиною. Графіт — непрозорий, темно-сірий, м'який.

Алмаз і графіт
Хімічний елемент і проста речовина
Назви хімічного елемента і простої речовини у більшості випадків збігаються, тому слід розрізняти ці два поняття.
Хімічний елемент — це певний вид атомів. Атоми хімічного елемента можуть входити до складу простих і складних речовин. Можна охарактеризувати поширеність і форми знаходження хімічного елемента в природі, а також властивості його атомів (масу, розміри, будову).
Проста речовина — це одна з форм існування хімічного елемента в природі. Проста речовина характеризується певним складом, будовою, фізичними і хімічними властивостями. Її використовують для отримання інших речовин.
Приклад:
|
Хімічний елемент |
Проста речовина |
|
Відносна атомна маса Оксигену дорівнює 16 |
Кисень погано розчиняється у воді |
|
Нітроген входить до складу білків |
Азот використовують для отримання аміаку |
|
Атоми Гідрогену входять до складу молекул води |
Водень легший за повітря |
- Хімічні елементи входять до складу складних речовин (хімічних сполук).
Складними називаються речовини, до складу яких входять атоми різних хімічних елементів.
Більшість хімічних речовин є складними.
Багато складних речовин мають молекулярну будову. До молекулярних відносяться метан CH4, вода H2O, вуглекислий газ CO2, сульфатна кислота H2SO4, глюкоза C6H12O6. Пластмаси, білки, жири, крохмаль теж є складними речовинами, що складаються з молекул.
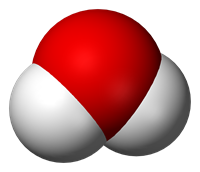
Модель молекули води
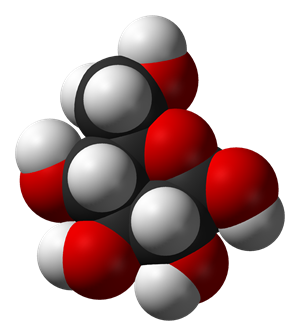
Модель молекули глюкози
Немолекулярну будову мають пісок SiO2, а також усі складні речовини, до складу яких входять метали: кухонна сіль NaCl, крейда CaCO3, питна сода NaHCO3 тощо. Зі складних речовин немолекулярної будови складаються мінерали і гірські породи.
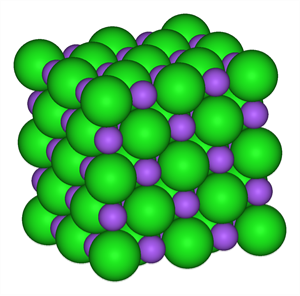
Модель кристала кухонної солі
За певних умов складні речовини можна розкласти на кілька нових речовин. Так, під дією електричного струму вода розкладається на водень і кисень, а цукор при нагріванні перетворюється на вугілля і воду.
Водень і кисень зовсім не схожі на воду. За нормальних умов водень і кисень є газами, а вода — рідина. Вугілля і вода нічим не нагадують цукор.
Зверни увагу!
Властивості складної речовини не є сумою властивостей речовин, що утворюються при її розкладанні.
1


про публікацію авторської розробки
Додати розробку
